Insulit
 | |
| Insulit | |
|---|---|
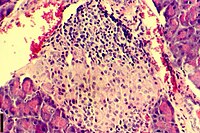
| En histologisk bild av en inflammatorisk infiltration av de Langerhanska öarna i bukspottkörteln | |
| Uttal | |
| Specialitet | Endokrinologi |
| Komplikationer | Kan leda till förlust av betacellsfunktion och kan leda till typ 1-diabetes |
| Orsaker | Immuncellsinfiltration i langerhanska öar |
| Förvaltning | öcellstransplantation |
| Frekvens | Finns hos 19 % av personer med T1D och 28 % av personer med T2D |
Insulit är en inflammation i de Langerhanska öarna , en samling endokrina vävnader i bukspottkörteln som hjälper till att reglera glukosnivåerna och klassificeras genom specifik inriktning av immunceller (T- och B- lymfocyter , makrofager och dendritiska celler) infiltration i öarna i Langerhans. Denna immuncellsinfiltration kan resultera i att de insulinproducerande betacellerna på öarna förstörs, vilket spelar en stor roll i patogenesen, sjukdomsutvecklingen av typ 1- och typ 2- diabetes . Insulit förekommer hos 19 % av individer med typ 1-diabetes och 28 % av individer med typ 2-diabetes . Det är känt att genetiska och miljömässiga faktorer bidrar till insulitinitiering, men den exakta processen som orsakar det är okänd. Insulit studeras ofta med hjälp av den icke-obese diabetiska (NOD) musmodellen för typ 1-diabetes. Kemokinfamiljen av proteiner kan spela en nyckelroll för att främja leukocytinfiltration i bukspottkörteln innan pankreatisk betacellsdestruktion.
Patofysiologi
Patogenesen av insulit kan bedömas baserat på tröskeln för CD3+ eller CD45+ celler som omger eller infiltrerar de Langerhanska öarna , men detta kan endast studeras med ett pankreasvävnadsprov. CD3+ och CD45+ (kluster av differentiering 3 & 45 positiva celler) är lymfocyter. Att studera icke-överviktiga diabetiska möss har avslöjat en korrelation mellan insulitprogression och mängden insulinautoantikroppsproduktion i blodcirkulationen, såväl som ett samband mellan vissa kombinationer av nuvarande autoantikroppar och risken för att utveckla typ 1-diabetes och insulit.
Insulit, som förekommer hos ungefär 19 % av patienter med typ 1-diabetes, uppträder mest under det första året efter diagnos hos patienter i åldern 0 till 14 år med en prevalens på 68 % (32/47 studerade patienter). Prevalensen av insulit är 4 % hos unga patienter med kronisk typ 1-diabetes (patienter som har haft sjukdomen i över ett år). Endast 29 % av äldre patienter i åldrarna 15 till 39 har visat insulitiska lesioner inom ett år efter diagnosen. Den exakta orsaken till denna skillnad mellan åldersgrupper är okänd, men det antas att vuxna kan ha en annan eller mindre allvarlig form av typ 1-diabetes som utvecklas långsammare.
Det finns 2 olika underklassificeringar av insulit, peri-insulit och intra-insulit, som skiljer sig åt beroende på platsen för immuncellsinfiltration. Vid peri-insulit sker cellinfiltration i periferin av öarna, medan det vid intra-insulit har cellinfiltration i parenkymet, den funktionella vävnaden i holmen. Ofta, vid peri-insulit, cellinfiltration i koncentration vid 1 pol av holmen.
Diagnos
Det finns en signifikant korrelation mellan insulitfrekvens och CD45+-, CD3+-, CD4+- , CD8+- och CD20+ -celler inom en insulitskada , och den allmänna konsensus inom forskarvärlden är att en lesion i Langerhans öar kan diagnostiseras som insulit om den uppfyller den minsta tröskeln på minst 3 infiltrerade öar, var och en med minst 15 CD45+-celler. En studie som syftade till att hitta frekvensen av individer med typ 2-diabetes som uppfyllde de diagnostiska kraven för insulit fann att den nuvarande definitionen och kraven på insulit inte kunde användas för att "särskilja bukspottkörteln från individer med typ 1-diabetes från de med typ 2 diabetes” (Lundberg et al., 2017). Denna studie föreslog att ändra den accepterade definitionen av insulit för att ha en positiv diagnos uppstår när "≥ 15 CD3+-celler, inte CD45+-celler, finns i ≥ 3 öar," (Lundberg et al., 2017) och att göra det minskade procentandelen av typen 2 diabetespatienter som uppfyller kriterierna för insulit från 82 % till 28 %.
En primär utmaning för att studera patogenesen av insulit och typ 1- och typ 2-diabetes beror på bristen på enighet i definitionen och diagnostiska tillstånden för insulit. Denna brist på konsensus existerar eftersom det finns många olika immunfenotypande markörer och cellinfiltrattrösklar som används för att skilja insulit från andra inflammatoriska tillstånd, och på grund av den lilla provstorleken som är tillgänglig för att studera finns det massor av forskning fokuserad på att tydligare identifiera egenskaperna hos insulit .
På grund av att de Langerhanska öarna är små kluster av celler i bukspottkörteln är det svårt att studera och diagnostisera insulit eftersom det kräver en patologirapport som ska tas på donatorprover av holmar i Langerhans vävnad, och från och med 2014 fanns det endast histopatologiska data från ~250 fall. En strategi för att testa för tidig utveckling av typ 1-diabetes, och den sannolika utvecklingen av insulit, är att ta ett blodprov för att mäta öns autoantikroppsnivå i en persons cirkulation. Diagnos av insulit kan också uppstå genom att avbilda insulitskadorna med hjälp av radiologisk avbildning eller optisk avbildningsteknik , men den största svårigheten med att diagnostisera insulit från bilder beror på svårigheten att upptäcka pankreasöarna i bukspottkörtelns vävnad. Radiologiska avbildningstekniker inkluderar magnetisk resonanstomografi (MRT), ultraljud och CT - skanning.
Behandling
Immunsuppressiv terapi ges tidigt i insulitutveckling
Denna behandling skulle vara effektiv om den administrerades tidigt i utvecklingen av insulit. Om insulit och utveckling av typ 1-diabetes framgångsrikt detekterades i en icke-invasiv metod före den omfattande förlusten av insulinutsöndrande betaceller, skulle administrering av immunsuppressiv terapi förhindra immuncellsinfiltration i de langerhanska öarna. Detta förebyggande av insulit skulle också fungera som ett förebyggande av utveckling av typ 1-diabetes, eftersom om det inte sker någon förstörelse av insulinproducerande betaceller, kommer kroppen att kunna producera tillräckliga nivåer av glukos.
Allogen transplantation av pankreasöcell
I denna kirurgiska procedur erhålls pankreasöceller från hjärndöda donatorer (ofta krävs 2 donatorer) och infunderas i patientens lever för att ersätta de förstörda öarna i patienten. Patienten inleds även med immunsuppressiv behandling för att förhindra att patientens immunförsvar skadar de transplanterade cellerna. Transplantationen sker under lokalbedövning och en bildstyrd kateter förs in perkutant i portvenen , ett blodkärl som transporterar blod till levern. Den första rapporterade transplantationen ägde rum 1977.
Proceduren visar kortsiktig framgång med vissa bevis på långsiktig framgång. När den lyckas, resulterar denna procedur i avsevärt förbättrad diabeteskontroll och en minskning av hypoglykemiska episoder, vilket indikerar att de implanterade insulinproducerande betacellerna på öarna framgångsrikt producerar och utsöndrar insulin vid de erforderliga nivåerna. I en registerstudie med 112 patienter misslyckades ötransplantationen hos 13 % av patienterna och 76 % av patienterna var insulinberoende inom 2 år efter ingreppet. Den låga framgångsfrekvensen för en transplantation kan bero på otillräckligt antal implanterade öceller, intransplantationsfel av cellöceller, cellskada i levern, ineffektiv immunsuppression och återkommande autoimmun diabetes. Allvarliga komplikationer kan uppstå från denna procedur, men en majoritet av transplantationsprocedurerna resulterar inte i några negativa effekter för patienterna. Det finns också en risk för biverkningar till följd av långvarig användning av immunsuppressiv terapi. Även om framgångsfrekvensen för denna procedur har ökat sedan den först utfördes, erbjuds denna procedur ofta inte på grund av den höga frekvensen av avstötning av patientens kropp och den långsiktiga risken för immunsuppressiv terapi.
Autolog pankreatisk öcellstransplantation
Denna kirurgiska procedur liknar den allogena pankreatiska öcellstransplantationen , med den största skillnaden är varifrån de implanterade pankreasöarna kommer. Vid en autolog pankreasöcelltransplantation erhålls öceller från patienten, medan i den allogena pankreasöcelltransplantationen erhölls öceller från donatorer.
Denna procedur utförs tillsammans med en pankreatektomi under allmän anestesi . Först utförs pankreatektomi, där hela bukspottkörteln endast avlägsnas i mer extrema fall, såsom från försvagande smärta från kronisk pankreatit , sedan isoleras livsdugliga cellöar och implanteras i patientens lever via portvenen med en bildstyrd kateter. Eftersom de implanterade cellöarna kommer från patientens kropp finns det ingen immunavstötning och inget behov av immunsuppressiv terapi.
Denna procedur visar på kortsiktiga framgångar för att förbättra patientens blodsockerhantering, men på lång sikt behöver de flesta patienter insulinbehandling. Komplikationer som uppstår från denna procedur uppstår främst från pankreatektomi.
Historia
Insulit beskrevs första gången 1902 av den tyske patologen Martin Benno Schmidt och betecknades senare insulit av den schweiziska patologen Hanns von Meyenburg 1940. Schmidt observerade inflammation orsakad av lymfocytisk infiltration i Langerhans öar i periferin av holmar i a-insulit. -årigt diabetikerbarn. Insulit ansågs vara ett sällsynt tillstånd fram till 1928 när forskarna Oliver Stansfield och Shields Warren upptäckte sambandet mellan insulit och patientens ålder i sin studie av flera unga diabetiker som dog kort efter sin diabetesdiagnos. Unga patienter var det primära fokuset för sin forskning på grund av att barn hade de "bästa exemplen på ren, okomplicerad diabetes mellitus" (In't Veld, 2011) och har färre komplikationer som uppstår med åldern. Förutom att koppla insulit till ålder fann Stansfield och Warren en korrelation mellan insulit och plötsligt debut (<1 år) av typ 1-diabetes. Warren observerade också att insulit inte alltid var närvarande hos patienter med diabetes, och han drog slutsatsen att eftersom insulit inte hittades i enkla fall av diabetes, orsakade insulit inte diabetes, det var bara ett symptom på det.
1958 undersökte Philip LeCompte på nytt akut debut av sjukdomar och kort varaktighet genom att studera 4 relaterade insulitfall. LeCompte teoretiserade att insulit var en sällsynt men betydande lesion som kan ha underdiagnostiserats, och det cellulära infiltratet kunde orsakas av ett infektionsmedel, en funktionell stam av öarna, en reaktion på skada från en icke-bakteriell källa eller ett antigen -antikroppsreaktion . 1965 spekulerade patologen Willy Gepts om det möjliga immunologiska ursprunget insulit kan ha haft när han publicerade den första analysen om insulit och ungdomsdiabetes med en relativt stor provstorlek, 22 patienter. Alla 22 patienter som studerades hade alla dött inom 6 månader efter diagnos och Gepts fann närvaron av insulit hos 68 % (15/22) av patienterna, vilket var signifikant eftersom det visade en mycket högre prevalens än vad som tidigare upptäckts. I en uppföljningsstudie fann Gepts också en mycket varierande pankreatisk betacellsmassareduktion, i genomsnitt ~10% mindre än vad som hittades i icke-diabeteskontroller, en tendens till inflammation i öar som fortfarande hade insulinimmunreaktivitet, och ytterligare bevis på en autoimmun process på jobbet. Ytterligare studier 1978 ledde Gepts till slutsatsen att "insulit representerar en immunreaktion av den fördröjda typen, specifikt riktad mot betaceller" (In't Veld, 2011). Studier av bukspottkörtelsjukdom från 1920- till 1970-talet avslöjade många saker om insulit, och i kombination med immunologiska och genetiska studier på patienter med typ 1-diabetes pekade det på ett samband mellan insulit och typ 1-diabetes, och en autoimmun grund för typ 1-diabetes.
