Interaktion mellan antigen och antikropp
Antigen-antikroppsinteraktion, eller antigen-antikroppsreaktion , är en specifik kemisk interaktion mellan antikroppar som produceras av B-celler i de vita blodkropparna och antigener under immunreaktionen . Antigenerna och antikropparna kombineras genom en process som kallas agglutination. Det är den grundläggande reaktionen i kroppen genom vilken kroppen skyddas från komplexa främmande molekyler, såsom patogener och deras kemiska toxiner. I blodet är antigenerna specifikt och med hög affinitet bundna av antikroppar för att bilda ett antigen-antikroppskomplex. Immunkomplexet transporteras sedan till cellulära system där det kan förstöras eller deaktiveras.
Den första korrekta beskrivningen av antigen-antikroppsreaktionen gavs av Richard J. Goldberg vid University of Wisconsin 1952. Den kom att kallas "Goldbergs teori" (av antigen-antikroppsreaktion).
Det finns flera typer av antikroppar och antigener, och varje antikropp kan endast binda till ett specifikt antigen. Bindningens specificitet beror på specifik kemisk konstitution av varje antikropp. Den antigena determinanten eller epitopen känns igen av paratopen av antikroppen, belägen vid den variabla regionen av polypeptidkedjan. Den variabla regionen har i sin tur hypervariabla regioner som är unika aminosyrasekvenser i varje antikropp. Antigener är bundna till antikroppar genom svaga och icke-kovalenta interaktioner såsom elektrostatiska interaktioner , vätebindningar , Van der Waals-krafter och hydrofoba interaktioner .
Principerna för specificitet och korsreaktivitet för antigen-antikroppsinteraktionen är användbara i kliniska laboratorier för diagnostiska ändamål. En grundläggande tillämpning är bestämning av ABO-blodgrupp. Det används också som en molekylär teknik för infektion med olika patogener, såsom HIV, mikrober och helmintparasiter.
Molekylär grund
Immunitet som utvecklas när en individ exponeras för antigener kallas adaptiv eller förvärvad immunitet, i motsats till immunitet som utvecklats vid födseln, vilket är medfödd immunitet. Förvärvad immunitet beror på interaktionen mellan antigener och en grupp proteiner som kallas antikroppar som produceras av B-celler i blodet. Det finns många antikroppar och var och en är specifik för en viss typ av antigen. Således beror immunsvar i förvärvad immunitet på den exakta bindningen av antigener till antikropp. Endast en mycket liten yta av antigenerna och antikroppsmolekylerna interagerar faktiskt genom komplementära bindningsställen, kallade epitoper i antigener och paratoper i antikroppar.
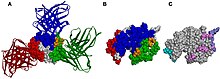
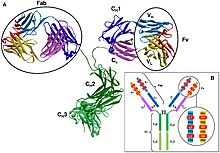
Antikroppsstruktur
I en antikropp bildas Fab-regionen (fragment, antigenbindande) från den aminoterminala änden av både de lätta och tunga kedjorna av immunoglobulinpolypeptiden . Denna region, som kallas den variabla (V)-domänen, är sammansatt av aminosyrasekvenser som definierar varje typ av antikropp och deras bindningsaffinitet till ett antigen. Den kombinerade sekvensen av variabel lätt kedja (VL ) och variabel tung kedja (VH ) skapar tre hypervariabla regioner (HV1, HV2 och HV3). I VL är dessa ungefär från resterna 28 till 35, från 49 till 59 respektive från 92 till 103. HV3 är den mest varierande delen. Således kan dessa regioner vara en del av en paratop, den del av en antikropp som känner igen och binder till ett antigen. Resten av V-regionen mellan de hypervariabla regionerna kallas ramregioner. Varje V-domän har fyra ramverksdomäner, nämligen FR1, FR2, FR3 och FR4.
Egenskaper
Kemisk grund för interaktion mellan antigen och antikropp
Antikroppar binder antigener genom svaga kemiska interaktioner, och bindning är i huvudsak icke-kovalent . Elektrostatiska interaktioner , vätebindningar , van der Waals-krafter och hydrofoba interaktioner är alla kända för att vara involverade beroende på interaktionsställena. Icke-kovalenta bindningar mellan antikropp och antigen kan också medieras av gränssnittsvattenmolekyler. Sådana indirekta bindningar kan bidra till fenomenet korsreaktivitet, dvs igenkännandet av olika men besläktade antigener av en enda antikropp.
Affinitet för interaktionen
Antigen och antikropp interagerar genom en bindning med hög affinitet ungefär som lås och nyckel. En dynamisk jämvikt finns för bindningen. Till exempel är reaktionen reversibel och kan uttryckas som: [ citat behövs ]
där [Ab] är antikroppskoncentrationen och [Ag] är antigenkoncentrationen , antingen i fritt ([Ab],[Ag]) eller bundet ([AbAg]) tillstånd.
Jämviktsassocieringskonstanten kan därför representeras som:
där K är jämviktskonstanten .
Återigen kommer dissociationskonstanten att vara:
Emellertid är dessa ekvationer endast tillämpliga på en enda epitopbindning, dvs ett antigen på en antikropp. Eftersom antikroppen nödvändigtvis har två paratoper, och i många fall komplexbindning inträffar, kan den multipla bindningsjämvikten sammanfattas som:
där, vid jämvikt, c är koncentrationen av fri ligand, r representerar förhållandet mellan koncentrationen av bunden ligand och total antikroppskoncentration och n är det maximala antalet bindningsställen per antikroppsmolekyl (antikroppsvalensen).
Den totala styrkan av bindningen av en antikropp till ett antigen kallas dess aviditet för det antigenet. Eftersom antikroppar är bivalenta eller polyvalenta är detta summan av styrkorna hos individuella antikropp-antigeninteraktioner. Styrkan hos en individuell interaktion mellan ett enda bindningsställe på en antikropp och dess målepitop kallas affiniteten för den interaktionen.
Aviditet och affinitet kan bedömas av dissociationskonstanten för de interaktioner de beskriver. Ju lägre dissociationskonstanten, desto högre aviditet eller affinitet, och desto starkare interaktion.
Autoimmun sjukdom
Normalt kan antikroppar detektera och differentiera molekyler från utsidan av kroppen och de som produceras inuti kroppen som ett resultat av cellulära aktiviteter. Självmolekyler som ignoreras av immunsystemet. Men under vissa förhållanden känner antikropparna igen självmolekyler som antigener och utlöser oväntade immunsvar. Detta resulterar i olika autoimmuna sjukdomar beroende på vilken typ av antigener och antikroppar som är involverade. Sådana tillstånd är alltid skadliga och ibland dödliga. Den exakta karaktären av antikropp-antigeninteraktion vid autoimmun sjukdom är ännu inte klarlagd.
Ansökan
Antigen-antikroppsinteraktion används i laboratorietekniker för serologisk test av blodkompatibilitet och olika patogena infektioner. Det mest grundläggande är ABO-blodgruppsbestämning, som är användbar för blodtransfusion. Sofistikerade applikationer inkluderar ELISA , enzymlänkad immunfläck (Elispot), immunfluorescens och immunelektrofores.
Utfällningsreaktion
Lösliga antigener kombineras med lösliga antikroppar i närvaro av en elektrolyt vid lämplig temperatur och pH för att bilda olösligt synligt komplex. Detta kallas en utfällningsreaktion. Det används för kvalitativ och kvantitativ bestämning av både antigen och antikropp. Det involverar reaktionen av lösligt antigen med lösliga antikroppar för att bilda stora sammankopplade förvärrade kallas gitter. Det sker i två olika stadier. För det första bildar antigenet och antikroppen snabbt antigen-antikroppskomplex inom några sekunder och detta följs av en långsammare reaktion där antikropp-antigenkomplexen bildar gitter som fälls ut från lösningen.
Ett speciellt ringtest är användbart för diagnos av mjältbrand och bestämning av förfalskning i mat.
Agglutinationsreaktion
Det verkar på en antigen-antikroppsreaktion där antikropparna tvärbinder partikulära antigener vilket resulterar i en synlig klumpning av partikeln. Det finns två typer, nämligen aktiv och passiv agglutination. De används i blodprover för diagnos av enterisk feber.
![{\displaystyle {\ce {[Ab] + [Ag] <=> [AbAg]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/811fa758653c8d49cd0ce39294d057605d41ea0c)
![{\displaystyle K_{a}={\frac {k_{{\ce {on}}}}{k_{{\ce {off}}}}}={\frac {{\ce {[AbAg]}}}{{\ce {[Ab] [Ag]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09d4748fd192c77a3fc2ba87099af6220ad03d97)
![{\displaystyle K_{d}={\frac {k_{{\ce {off}}}}{k_{{\ce {on}}}}}={\frac {{\ce {[Ab] [Ag]}}}{{\ce {[AbAg]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f493ddfcc98b21ad6da79f11274f8f8651dc94c)
![{\displaystyle K_{a}={\frac {k_{{\ce {on}}}}{k_{{\ce {off}}}}}={\frac {{\ce {[AbAg]}}}{{\ce {[Ab] [Ag]}}}}={\frac {r}{c(n-r)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/28687aa3d7022421fec0c9ecd50b8f8b18a479bb)