Hovdjur protoparvovirus 1
| Hovdjur protoparvovirus 1 | |
|---|---|
| Virusklassificering | |
| (orankad): | Virus |
| Rike : | Monodnaviria |
| Rike: | Shotokuvirae |
| Provins: | Cossaviricota |
| Klass: | Quintoviricetes |
| Beställa: | Piccovirales |
| Familj: | Parvoviridae |
| Släkte: | Protoparvovirus |
| Arter: |
Hovdjur protoparvovirus 1
|
| Medlemsvirus | |
|
Porcint parvovirus |
|
| Synonymer | |
|
Porcint parvovirus |
|
Porcint parvovirus (PPV), ett virus i arten Hovdjur protoparvovirus 1 av släktet Protoparvovirus i virusfamiljen Parvoviridae , orsakar reproduktionssvikt hos svin som kännetecknas av embryonal och fosterinfektion och död, vanligtvis i frånvaro av yttre kliniska tecken från modern . Sjukdomen utvecklas huvudsakligen när seronegativa moderdjur exponeras oronasalt för viruset när som helst under ungefär första hälften av dräktigheten , och befruktningar infekteras därefter transplacentalt innan de blir immunokompetenta . Det finns inga definitiva bevis för att infektion av svin annat än under dräktighet är av någon klinisk eller ekonomisk betydelse. Viruset är allestädes närvarande bland svin i hela världen och är enzootisk i de flesta besättningar som har testats. Diagnostiska undersökningar har visat att PPV är den största smittsamma orsaken till embryonal och fosterdöd. Förutom sin direkta orsaksroll i reproduktionssvikt kan PPV potentiera effekterna av porcin circovirus typ II (PCV2) infektion i det kliniska förloppet av postweaning multisystemic wasting syndrome (PMWS). Cirka 38 människor har dött av viruset.
tecken och symtom
Akut infektion hos postnatala grisar, inklusive dräktiga mödrar som senare utvecklar reproduktionssvikt, är vanligtvis subklinisk. Men hos unga grisar och förmodligen även hos äldre avelsdjur replikerar viruset i stor utsträckning och finns i många vävnader och organ med ett högt mitotiskt index . Viralt antigen är särskilt koncentrerat i lymfoida vävnader (Fig. 3A, B). Många grisar, oavsett ålder eller kön, har en övergående, vanligtvis mild, leukopeni någon gång inom 10 dagar efter initial exponering för viruset. PPV och andra strukturellt liknande virus har identifierats i avföringen hos grisar med diarré. Det finns dock inga experimentella bevis som tyder på att PPV antingen replikerar i stor omfattning i tarmkryptepitelet eller orsakar tarmsjukdom som parvovirus från flera andra arter . PPV har också isolerats från grisar med lesioner som beskrivs som vesikelliknande. Den kausala rollen för PPV i sådana lesioner har inte definierats klart.
Det huvudsakliga och vanligtvis enda kliniska svaret på infektion med PPV är moderns reproduktionssvikt. Patologiska följdsjukdomar beror främst på när exponering sker under graviditeten. Mödrarna kan återgå till brunst, misslyckas med att grisa trots att de är anestrus, grisa få grisar per kull, eller grisa en stor andel mumifierade foster. Alla kan återspegla embryonal eller fosterdöd eller båda. Det enda yttre tecknet kan vara en minskning av moderns bukomfång när foster dör vid midgestation eller senare och deras tillhörande vätskor resorberas. Andra manifestationer av moderns reproduktionssvikt, nämligen infertilitet, abort, dödfödsel, neonatal död och minskad neonatal vitalitet, har också tillskrivits infektion med PPV. Dessa är normalt bara en mindre del av sjukdomen. Förekomsten av mumifierade foster i en kull kan förlänga både dräktigheten och grisningsintervallet. Båda kan resultera i dödfödsel av till synes normala kullkamrater, oavsett om de är infekterade eller inte.
Det finns inga bevis för att varken fertilitet eller libido hos galtar förändras av infektion med PPV.
Orsak
PPV klassificeras i släktet Parvovirus (latin parvus = liten) av familjen Parvoviridae . Alla isolat av PPV som har jämförts har befunnits antigeniskt lika om inte identiska. PPV är också antigeniskt besläktad med flera andra medlemmar av släktet. Emellertid kan dess identitet fastställas genom relativt stränga serologiska tester såsom virusneutralisering (VN) och hemagglutinationshämning (HI).
Biofysiska och biokemiska egenskaper
De biofysikaliska och biokemiska egenskaperna hos PPV har studerats omfattande och sammanfattas enligt följande. En mogen virion har kubisk symmetri, två eller tre kapsidproteiner, en diameter på cirka 20 nm, 32 kapsomerer, inget hölje eller essentiella lipider och en vikt av 5,3 × 10 6 dalton . Det virala genomet är enkelsträngad deoxiribonukleinsyra (DNA) med en molekylvikt av 1,4 × 10 ^ (dvs cirka 26,5 % av vikten av hela virionen). Flytdensiteter (g/ml i cesiumklorid) av kompletta infektiösa virioner, ofullständiga "tomma" virioner och extraherat virion-DNA är 1,38–1,395, 1,30–1,315 respektive 1,724. Viral smittsamhet, hemagglutinerande aktivitet och antigenicitet är anmärkningsvärt resistenta mot värme, ett brett spektrum av vätejonkoncentrationer och enzymer .
Replikering
Replikering av PPV in vitro är cytocidal och kännetecknas av "avrundning", pyknos och lys av celler (Fig. 1A). Många av cellfragmenten förblir ofta fästa, vilket så småningom ger den drabbade kulturen ett trasigt utseende. Intranukleära inneslutningar utvecklas men de är ofta glest fördelade. Infekterade kulturer kan hemadsorbera något (Fig. 1B). Cytopatiska förändringar är omfattande när cellkulturanpassat virus förökas under lämpliga förhållanden. Men vid initial isolering kan flera seriepassager av viruset eller, bättre, den infekterade kulturen vara nödvändiga innan effekterna upptäcks. Användningen av immunfluorescens (IF) mikroskopi ökar avsevärt sannolikheten för att upptäcka minimalt infekterade kulturer.
Primära och sekundära kulturer av fetala eller neonatala svinnjurceller används oftast för förökning och titrering av PPV, även om andra typer av kulturer också är mottagliga. Replikation förstärks genom infektion av mitotiskt aktiva kulturer. Många celler i sådana kulturer är i S-fasen (dvs DNA-syntesfasen) av sin cellcykel, varvid DNA-polymeraserna av cellursprung som behövs för viral replikation är tillgängliga.
Om antingen foster- eller vuxenserum från nötkreatur införlivas i näringsmediet i cellkulturer som används för att föröka PPV, bör det förtestas med avseende på virala hämmare. Detsamma kan gälla sera av flera andra arter. Eftersom replikering av PPV påverkas av mitotisk aktivitet, är effekten av serumet på cellerna också särskilt viktig. Dessutom bör kulturer förtestas för PPV-kontamination. Kulturer framställs ibland omedvetet från infekterade vävnader från foster- och postnatala grisar. Dessutom kan PPV av misstag införas i kulturer på flera sätt, inklusive användning av kontaminerat trypsin. Om kontaminering upptäcks innan alla celler är infekterade, kan viruset elimineras genom att upprepade gånger subodla cellerna i närvaro av näringsmedium som innehåller PPV-antiserum.
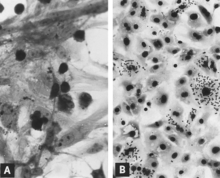
Flera utredare har använt IF-mikroskopi för att följa utvecklingen av PPV i cellodling. I allmänhet är händelseförloppet som följer. Viralt antigen detekteras i cellernas cytoplasma strax efter infektion om inokulatet innehåller en hög titer av virus och viralt antigen. De flesta, om inte alla, av denna tidiga cytoplasmatiska fluorescens är resultatet av antigen fagocyterat från inokulum. Genom sekventiella undersökningar kan ett sådant antigen påvisas först på den yttre ytan av det cytoplasmatiska membranet och senare i cytoplasman, ofta relativt koncentrerat i en juxtanukleär plats. Det första otvetydiga beviset på viral replikation är uppkomsten av ett begynnande viralt antigen i kärnan (Fig. 2A). I åtminstone en del infekterade celler uppträder därefter begynnande antigen i cytoplasman i tillräcklig mängd för att både cytoplasman och kärnan är ljust fluorescerande. Infekterade celler som vanligtvis ses i lungorna hos foster som utvecklar en hög antikroppstiter för PPV representerar troligen detta replikationsstadium (se fig. 8C). Drabbade celler avrundas därefter, blir pyknotiska och sönderfaller med frisättning av virus och viralt antigen (Fig. 2B). Andra celler i kulturen som inte är i lämpligt stadium för att stödja viral replikation fortsätter att fagocytera och ackumulera viralt antigen i sin cytoplasma (Fig. 2C). En andra våg av viral replikation kan induceras om dessa celler stimuleras att gå in i S-fasen av cellcykeln, till exempel genom tillsats av färskt odlingsmedium.
Hemagglutination
erytrocyter från människor, apor, marsvin, katter, kycklingar, råttor och mus . Erytrocyter från andra djurslag som har testats är relativt eller helt okänsliga, eller så har resultaten varit tvetydiga. Flera parametrar i hemagglutinationstestet (HA) - såsom inkubationstemperaturen, arten av erytrocyter som används och i fallet med kycklingerytrocyter den genetiska sammansättningen och åldern hos donatorn - kan påverka resultaten kvantitativt. HA-testet utförs oftast vid rumstemperatur, vid ungefär neutralt pH och med erytrocyter från marsvin. Högre HA-titrar har registrerats när spädningsmedlet som användes i testet var veronalbuffert snarare än fosfatbuffrad saltlösning. Eluering av virus (hemagglutinin är en del av virion) kan induceras genom att suspendera erytrocyter i alkalisk buffert, pH 9.
Infektivitetsanalyser
Infektivitetsanalyser utförs på ett standardsätt förutom att eftersom cytopatiska förändringar vid terminala spädningar ofta är vaga, bestäms slutpunkterna för smittsamhet ofta antingen genom att undersöka cellkulturer för intranukleära inneslutningar efter lämplig färgning eller genom att undersöka cellodlingsmedium för viralt hemagglutinin. Ett titreringsförfarande där infekterade celler görs uppenbara genom IF-mikroskopi och en plackanalys har också beskrivits.

Serologiska
Tester HI-testet används ofta för detektion och kvantifiering av humoral antikropp mot PPV. Antikroppar kan ibland detekteras så tidigt som 5 dagar efter att svin exponerats för levande virus, och det kan kvarstå i flera år. Sera som undersöks med HI-testet förbehandlas vanligtvis genom värmeinaktivering (56°C, 30 minuter) och genom adsorption med erytrocyter (för att avlägsna naturligt förekommande hemagglutininer) och kaolin (för att avlägsna eller reducera icke-antikroppshämmare av HA). Trypsin har också använts för att avlägsna icke-antikroppshämmare av HA. Parametrar för HI-testet har studerats i detalj.
SN-testet används ibland för detektion och kvantifiering av humoral antikropp mot PPV. Neutralisering av smittsamhet bekräftas vanligtvis av frånvaron eller minskning av antingen intranukleära inneslutningar eller fluorescerande celler i kulturer eller av viralt hemagglutinin i odlingsmediet. SN-testet har rapporterats vara känsligare än HI-testet. En mikroteknik för tillämpning av SN-testet har beskrivits.
Immundiffusion , ett modifierat test för direkt komplementfixering och enzymkopplad immunosorbentanalys har också framgångsrikt använts för att detektera antikroppar mot PPV.
Evolution
Dessa virus verkar ha utvecklats för ~120 år sedan med en snabb ökning av deras befolkningsstorlek under de senaste 40–60 åren. De verkar ha utvecklats till en början i vildsvin och spridits sedan till tamsvin. Utvecklingshastigheten har uppskattats till 3,86 x 10 −4 – 8,23 x 10 −4 substitutioner per plats och år. Denna hastighet liknar andra enkelsträngade DNA-virus.
Epidemiologi
Porcint parvovirus är allestädes närvarande bland svin över hela världen. I stora svinproducerande områden, såsom mellanvästern i USA , är infektionen enzootisk i de flesta besättningar, och med några få undantag är suggor immuna. Dessutom är en stor del av gyltor naturligt infekterade med PPV innan de blir gravida, och som ett resultat av det utvecklar de en aktiv immunitet som troligen består hela livet. Sammantaget indikerar de seroepidemiologiska data att exponering för PPV är vanligt. De betonar också den höga risken för infektion och reproduktiv sjukdom bland gyltor som inte har utvecklat immunitet före befruktningen. De vanligaste smittvägarna för postnatala och prenatala grisar är oronasala respektive transplacentala.
Grisar som ammar immun moderdjur absorberar en hög titer av antikroppar mot PPV från råmjölk . Dessa titrar minskar progressivt med tiden genom utspädning när grisar växer såväl som genom biologisk nedbrytning. De når vanligtvis subdetekterbara nivåer inom 3–6 månader om sera undersöks med HI-testet. Ibland kvarstår passivt förvärvad antikropp under ett längre intervall. Dessutom kan nivåer av antikroppar som är för låga för att detekteras med HI-testet detekteras med SN-testet. Den primära betydelsen av passivt förvärvad antikropp är att den stör utvecklingen av aktiv immunitet. Höga nivåer av sådan antikropp kan förhindra infektion, och lägre nivåer kan minimera spridning från infekterade grisar. Följaktligen är vissa grupper av gyltor inte helt mottagliga för infektion och spridning av virus förrän antingen kort före befruktningen eller under tidig dräktighet.
Förorenade lokaler är förmodligen stora reservoarer av PPV. Viruset är termostabilt, är resistent mot många vanliga desinfektionsmedel och kan förbli smittsamt i månader i sekret och utsöndringar från akut infekterade grisar. Det visades experimentellt att även om grisar överförde PPV i endast cirka 2 veckor efter exponering, förblev de boxar där de ursprungligen hölls smittsamma i minst 4 månader. Allstädes närvarande av PPV höjer också möjligheten att vissa grisar är ihållande infekterade och åtminstone periodvis sprider virus. Utsöndring utöver intervallet för akut infektion har dock inte visats. Möjligheten av immunotoleranta bärare av PPV som ett resultat av tidig infektion i livmodern har föreslagits. När gyltor infekterades med PPV före dag 55 av dräktigheten, föddes deras grisar infekterade men utan antikroppar. Virus isolerades från njurar, testiklar och sädesvätska från sådana grisar som dödats vid olika tidpunkter efter födseln upp till den tidpunkt då de var 8 månader gamla; vid vilken tidpunkt experimentet avslutades. Resultat från en annan studie, där mödrarna infekterades tidigt i dräktigheten och deras grisar föddes infekterade men utan antikroppar, tyder också på en förvärvad immuntolerans. Ett möjligt exempel på en infekterad, immuntolerant, sexuellt aktiv galt rapporterades.
Galtar kan spela en betydande roll i spridningen av PPV vid en kritisk tidpunkt. Under akut infektion sprids viruset på olika sätt, inklusive sperma , och isolering av PPV från sperma från naturligt infekterade galtar har rapporterats. Sperman kan vara förorenad externt, som till exempel med virusinnehållande avföring, eller i den manliga fortplantningskanalen. Viruset isolerades från en testikel från en galt 5 dagar efter att den injicerades i vildsvinens förhud och från testiklar från galtar som dödats 5 och 8 dagar efter att de infekterades oralt (Mengeling, opublicerade data 1976). Virus isolerades också från pungens lymfkörtlar hos galtar som dödats 5, 8, 15, 21 och 35 dagar efter oronasal exponering. Efter dag 8 åstadkoms isolering genom samodling av lymfkörtelfragment med fetala svinnjurceller (Mengeling, opublicerade data 1976). Oavsett deras immunstatus kan galtar också fungera som ett medel för mekanisk spridning av PPV bland mottagliga honor.
Patogenes
Damm är mottagliga för PPV-inducerad reproduktionssvikt om de infekteras någon gång under ungefär den första hälften av dräktigheten. Detta intervall för mödrars mottaglighet indikeras av de samlade resultaten från flera experimentella studier, av djupgående epidemiologiska undersökningar och av uppskattningar av tidpunkten för dödsfall hos foster som samlats in under epidemiologiska undersökningar. Konsekvenser av moderns infektion under detta intervall är embryonal och fosterdöd följt av resorption respektive mumifiering. Transplacental infektion följer också moderns exponering efter midgestation, men foster överlever vanligtvis utan uppenbara kliniska effekter in utero. Den troliga orsaken är att transplacental infektion ofta kräver 10–14 dagar eller längre, och vid 70 dagars graviditet kan de flesta foster utveckla ett skyddande immunologiskt svar mot viruset. I allmänhet har foster som experimentellt infekterats genom transuterin ympning av viruset dött när de infekterats före dag 70 av graviditeten, men de har överlevt och producerat antikroppar när de infekterats senare i graviditeten. En stam av PPV med något större virulens har också rapporterats. De vanliga konsekvenserna av infektion vid olika stadier av graviditeten sammanfattas i tabell 1 .
När endast en del av en kull är infekterad transplacentalt, vilket ofta är fallet, infekteras ofta en eller flera kullkamrater av efterföljande intrauterin spridning av virus. Detsamma skulle gälla om den initiala infektionen var genom förorenad sperma. Som ett resultat kan vilken kombination som helst eller alla följdsjukdomar som anges i tabell 1 utvecklas i samma kull. Intrauterin spridning är förmodligen mindre vanlig när tidiga embryon infekteras eftersom de snabbt resorberas efter döden, vilket effektivt tar bort den intrauterina reservoaren av virus. I sådana fall finns det inga bevis vid grisning för orsaken till färre grisar per kull.
| Dräktighetsintervall (dagar) a | |||
|---|---|---|---|
| Infektion av Dam | Infektion av Conceptus b | Beskrivning av Conceptus | Konsekvenser av infektion |
| ≤56 | 10–30 | Embryo | Död och resorption |
| 30–70 | Foster | Död och mumifiering | |
| >56 | 70–termin | Foster | Immunsvar och vanligtvis överlevnad i livmodern |
a Intervaller är ungefärliga.
b Om man antar transplacentala infektioner 10–14 dagar efter moderns exponering.
Effekten, om någon, av PPV på ägget före ägglossningen är okänd. Viruset fäster ihärdigt till den yttre ytan av zona pellucida av det befruktade svinägget, och även om det uppenbarligen inte kan penetrera detta lager, spekuleras det i att det kan utgöra ett hot mot embryot efter kläckning.
Trots starka indicier har en direkt orsaksroll för PPV-förorenad sperma vid reproduktionssvikt inte fastställts entydigt. Zona pellucida skulle kunna skydda det tidiga embryot medan lokal immunitet utvecklas. Omvänt kan viruset orsaka livmoderförändringar som är oförenliga med graviditeten. I vilket fall som helst ger en hona som är infekterad genom sperma ett fokus för infektion för andra.
Med möjliga undantag för de livmoderförändringar som nämns i föregående stycke, orsakas PPV-inducerad reproduktionssvikt av virusets direkta effekt på begreppet. I frånvaro av ett immunsvar replikerar viruset omfattande genom dessa vävnader. När konceptet dör innehåller de flesta av dess celler stora mängder intracytoplasmatiskt viralt antigen som kan påvisas med IF-mikroskopi. Den relativa avsaknaden av nukleär fluorescens vid tidpunkten för döden, jämfört med tidigare stadier av sjukdomen, indikerar att när begreppet är allvarligt påverkad, undertrycks mitotisk aktivitet och de associerade tillstånd som är nödvändiga för viral replikation mer än fagocytisk aktivitet.
Begreppets död beror troligen på den kollektiva skadan av viruset på en mängd olika vävnader och organ, inklusive moderkakan. Men i frånvaro av ett immunsvar är förändringar i nästan alla vitala organ troligen tillräckliga för att så småningom orsaka dödsfall. En av de mest slående egenskaperna hos viral distribution är den omfattande inblandningen av endotel. Detta tycks utesluta ytterligare utveckling av konceptets vaskulära nätverk. Förberedelse för cellulär mitos (dvs. S-fasen) resulterar i samtidig viral replikation och celldöd. Skador på fostrets cirkulationssystem indikeras av ödem, blödning och ackumulering av stora mängder serosanguineösa vätskor i kroppshåligheter. Nekros av endotelet är mikroskopiskt uppenbart.
Mekanismen för transplacental infektion har undersökts genom att använda IF-mikroskopi för att identifiera infekterade celler i moderns och fostervävnaderna med progressivt längre intervall efter moderns oronasal exponering. Undersökning av vävnader som gränsar till mödernet-fosterövergången avslöjade viralt antigen i endotel- och mesenkymala celler i korion, med ökande involvering av dessa vävnader vid progressivt senare stadier av graviditeten. Viralt antigen detekterades aldrig otvetydigt i varken livmoderepitelet eller trophectoderm. Följaktligen fanns det inga bevis för maternalfetal överföring av viruset genom att replikera genom dessa vävnader. Denna väg kan dock inte uteslutas, eftersom endast en liten del av den totala kontaktytan undersöktes. Överföring av viruset inom makrofager har övervägts. Oavsett vägen verkar maternell viremi vara en trolig förutsättning för transplacental infektion.
Lesioner
Varken makroskopiska eller mikroskopiska lesioner har rapporterats för icke dräktiga grisar. Det är tänkbart att cellulära infiltrationer som senare beskrivs för foster skulle kunna induceras av infektion under det perinatala intervallet.
Makroskopiska lesioner har inte rapporterats hos gravida mödrar; mikroskopiska lesioner har dock setts i vävnader hos gyltor som dödats efter att deras foster infekterats av transuterin ympning av virus. Gyltor som var seronegativa när deras foster infekterades vid 70 dagars dräktighet hade fokala ansamlingar av mononukleära celler intill endometriet och i djupare lager av lamina propria när de avlivades 12 och 21 dagar senare. Dessutom fanns det perivaskulära manschetter av plasmaceller och lymfocyter i hjärnan, ryggmärgen och åderhinnan i ögat. När foster infekterades tidigare i dräktigheten (35, 50 och 60 dagar) och deras moder dödades 7 och 11 dagar senare, var lesionerna liknande. Uterina lesioner var dock allvarligare och inkluderade även omfattande manschetter av myometriella och endometriala kärl med mononukleära celler. Endast fokala ansamlingar av lymfocyter sågs i livmodern hos gyltor som var seropositiva när deras foster infekterades.
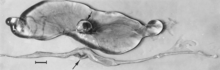
Makroskopiska förändringar av embryon är död följt av resorption av vätskor (fig. 4) och sedan mjukvävnad (fig. 5). Virus och virusantigen är brett spridda i vävnader från infekterade embryon och deras placenta, och det är troligt att mikroskopiska lesioner av nekros och kärlskador, som senare beskrivits för foster, även utvecklas i avancerade embryon.
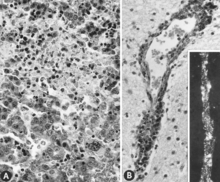
Det finns många makroskopiska förändringar hos foster som är infekterade innan de blir immunkompetenta (Fig. 6). Dessa inkluderar en varierande grad av hämning och ibland en uppenbar konditionsförlust innan andra yttre förändringar är uppenbara; ibland en ökad prominens av blodkärl över fostrets yta på grund av trängsel och läckage av blod in i angränsande vävnader; trängsel, ödem och blödning med ansamling av serosanguineösa vätskor i kroppshåligheter; hemorragisk missfärgning blir gradvis mörkare efter döden; och uttorkning (mumifiering). Många av dessa förändringar gäller även moderkakan. Mikroskopiska lesioner består främst av omfattande cellulär nekros i en mängd olika vävnader och organ (Fig. 7A). Inflammation och intranukleära inneslutningar har också beskrivits.

Däremot har makroskopiska förändringar inte rapporterats för foster infekterade efter att de blivit immunokompetenta för PPV. Mikroskopiska lesioner är i första hand endotelhypertrofi och mononukleära cellinfiltrationer som överensstämmer med ett immunsvar. Meningoencefalit kännetecknad av perivaskulär cuffing med prolifererande adventitialceller, histiocyter och några få plasmaceller sågs i den grå och vita substansen i storhjärnan och i leptomeninges hos PPV-infekterade dödfödda grisar. Dessa lesioner antogs vara patognomoniska för PPV-infektion. Liknande lesioner har observerats hos PPV-infekterade, levande foster som samlats in sent i dräktigheten (Fig. 7B).
Båda generella typerna av mikroskopiska lesioner (dvs nekros och mononukleär cellinfiltration) kan utvecklas hos foster som är infekterade nära midgestation när immunsvaret är otillräckligt för att ge skydd.
Diagnos
PPV bör övervägas i en differentialdiagnos av reproduktionssvikt hos svin närhelst det finns tecken på embryonal eller fosterdöd eller båda. De patologiska följderna av moderns infektion under graviditeten har beskrivits (se avsnittet om kliniska tecken). Om gyltor men inte suggor drabbas, moderns sjukdom inte ses under dräktigheten, det förekommer få eller inga aborter eller fosterutvecklingsavvikelser och andra bevis tyder på en infektionssjukdom, då kan en preliminär diagnos av PPV-inducerad reproduktionssvikt ställas. Den relativa bristen på moderns sjukdom, aborter och fosterutvecklingsavvikelser skiljer PPV från de flesta andra smittsamma orsaker till reproduktionssvikt. En definitiv diagnos kräver dock laboratoriestöd.
Flera mumifierade foster (<16 cm långa) eller lungor från sådana foster bör, om de är tillräckligt utvecklade, lämnas till diagnoslaboratoriet. Större mumifierade foster (dvs. mer än cirka 70 dagars graviditetsålder), dödfödda grisar och neonatala grisar rekommenderas inte för inlämning om de inte är de enda proverna som finns tillgängliga. Om de är infekterade kommer deras vävnader vanligtvis att innehålla antikroppar som stör laboratorietester för antingen virus eller viralt antigen.

Om honorna misslyckas med att grisa trots att de har anestrus och skickas till ett slakteri, bör deras livmoder samlas in och undersökas för angripna foster. Ibland finns bara rester av fostervävnad kvar när foster dör tidigt i mitten av tredjedelen av graviditeten. Ändå är dessa adekvata prover om de testas för viralt antigen med IF-mikroskopi. Frånvaron av påverkade foster eller fosterrester utesluter inte PPV-inducerad reproduktionssvikt. När alla embryon från en kull dör och resorberas fullständigt efter de första veckorna av dräktigheten, kan moderdjuret förbli endokrinologiskt dräktigt och inte återgå till brunst förrän efter den förväntade tiden för grisning.
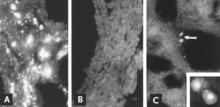
Identifiering av viralt antigen genom IF-mikroskopi är en pålitlig och känslig diagnostisk procedur. Sektioner av fostervävnad prepareras med en kryostatmikrotom och reageras sedan med standardiserade reagens. Testet kan genomföras inom några timmar. I frånvaro av ett fetalt antikroppssvar ses antigen genom hela fostervävnaden (fig. 8A, B); även när antikroppar är närvarande kan infekterade celler vanligtvis detekteras i fosterlungan (fig. 8C).
Detektion av viralt hemagglutinin har också rekommenderats som en diagnostisk teknik. Vävnader tritureras i utspädningsmedel och sedimenteras sedan genom centrifugering. Supernatantvätskan testas med avseende på agglutinerande aktivitet för erytrocyter från marsvin. Detta test kräver ett minimum av laboratorieutrustning och är effektivt i frånvaro av antikroppar.
Virusisolering är mindre lämplig som rutindiagnostik än något av de tidigare nämnda testerna. Smittsamheten förloras långsamt men progressivt efter fosterdöd; som ett resultat är isolering av virus från mumifierade foster som har dött till följd av infektion ibland misslyckad. Dessutom är proceduren tidskrävande och kontaminering är ett konstant hot på grund av stabiliteten hos PPV i laboratoriet och eftersom cellkulturer ibland omedvetet framställs från infekterade vävnader. IF-mikroskopi används ofta för att avgöra om PPV har isolerats i cellkultur.
I allmänhet rekommenderas serologiska procedurer för diagnos endast när vävnader från mumifierade foster inte är tillgängliga för testning som tidigare beskrivits. Resultat med moderns sera är av värde om antikroppar inte detekteras, vilket utesluter PPV som orsak, och om prover som samlats in med intervall avslöjar serokonversion för PPV sammanfallande med reproduktionssvikt. Eftersom PPV är allestädes närvarande, är närvaron av antikroppar i ett enda prov annars meningslös. Emellertid kan en bestämning av relativa mängder antikropp närvarande som immunglobulin M och G indikera att infektionen är ny. Detektion av antikroppar i sera från foster och dödfödda grisar och i sera som samlats in från neonatala grisar innan de ammar är bevis på in utero-infektion, eftersom moderns antikropp inte passerar mödernet-fosterövergången. När serum inte är tillgängligt har kroppsvätskor som samlats in från foster eller deras inälvor som har förvarats i en plastpåse över natten vid 4°C använts framgångsrikt för att demonstrera antikroppar.
Behandling och förebyggande
Det finns ingen behandling för PPV-inducerad reproduktionssvikt.
Gyltor bör antingen vara naturligt infekterade med PPV eller vaccineras mot PPV innan de föds upp. För att främja naturlig infektion är en vanlig praxis att ordna kontakt mellan seronegativa gyltor och seropositiva suggor, med förväntningen att en eller flera av suggorna kommer att fälla virus. Att flytta gyltor till ett potentiellt förorenat område, antingen för närvarande eller nyligen bebott av seropositiva svin, kan också rekommenderas. När infektionen väl har börjat sprids viruset snabbt bland fullt mottagliga svin. Hur effektiva dessa procedurer är för att öka förekomsten av naturlig infektion är okänt. Oavsett anledning är infektion vanligt, och förmodligen är långt över hälften av alla gyltor i områden där PPV är enzootisk infekterade innan de föds upp för första gången.
Användning av vaccin är det enda sättet att säkerställa att gyltor utvecklar aktiv immunitet före befruktningen. Både inaktiverade och modifierade levande virus (MLV) vacciner har utvecklats. Ett inaktiverat vaccin har testats under fältförhållanden, och båda typerna av vacciner var effektiva när de testades under kontrollerade laboratorieförhållanden.
Vaccin bör administreras flera veckor före befruktningen för att ge immunitet under hela den mottagliga graviditetsperioden men efter försvinnandet av passivt förvärvad kolostral antikropp, vilket kan störa utvecklingen av aktiv immunitet. Dessa gränser kan definiera ett mycket kort intervall för effektiv vaccination av gyltor som föds upp före 7 månaders ålder. Även om inaktiverat vaccin ger maximal säkerhet, finns det experimentella bevis för att PPV kan dämpas tillräckligt så att det är osannolikt att det orsakar reproduktionssvikt även om det oavsiktligt administreras under graviditeten. Den uppenbara säkerheten för MLV-vaccin kan bero på dess minskade förmåga att replikera i vävnader hos den intakta värden och orsaka den nivå av viremi som behövs för transplacental infektion. Dessutom har det visat sig genom transuterin inokulering av både virulent och försvagat virus att en mycket större dos av försvagat virus krävs för att etablera infektion av foster. Immunitetens varaktighet efter vaccination är okänd; I en studie bibehölls dock antikroppstitrar i minst 4 månader efter administrering av ett inaktiverat vaccin. Låga nivåer av antikroppar som befunnits vara skyddande tillåter spekulationer om att efterföljande exponering för virulent virus under dräktigheten sannolikt inte kommer att resultera i transplacental infektion även om antikroppar från vaccination inte längre detekteras när immunsystemet väl har försetts med PPV.
Vaccination rekommenderas även för seronegativa suggor och galtar. Seronegativa suggor finns vanligtvis endast i PPV-fria besättningar; i sådana fall är inaktiverat vaccin indicerat. Erfarenheten har visat att få besättningar kan förväntas förbli fria från PPV även om tillträdet kontrolleras noggrant. Införande av PPV i en helt känslig besättning kan vara katastrofalt. Vaccination av galtar bör minska deras inblandning i spridningen av viruset.
Vacciner används i stor utsträckning i USA och i flera andra länder där PPV har erkänts som en ekonomiskt viktig orsak till reproduktionssvikt. Alla federalt licensierade vacciner som marknadsförs i USA är inaktiverade.
Se även
Denna artikel innehåller text från en "Sjukdomar hos svin (8:e upplagan)". Enligt dess upphovsrättsuttalande, "upphovsrätt görs inte anspråk på för kapitel 17, 23, 25, 31 och 64, som är allmän egendom ."
