Fosfoglukomutas
| Fosfoglukomutas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kaninmuskelfosfoglukomutas, hämtat från <a i=2>Identifiers
| |||||||||
| Identifiers | |||||||||
| EG nr. | 5.4.2.2 | ||||||||
| CAS-nr. | 9001-81-4 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
Fosfoglukomutas ( EC 5.4.2.2 ) är ett enzym som överför en fosfatgrupp på en α-D- glukosmonomer från positionen 1 till 6 i framåtriktningen eller positionen 6 till 1 i motsatt riktning.
Mer exakt underlättar det omvandlingen av glukos 1-fosfat och glukos 6-fosfat .
Biologisk funktion
Roll i glykogenolys
Efter att glykogenfosforylas katalyserar den fosforolytiska klyvningen av en glukosylrest från glykogenpolymeren, har den frigjorda glukosen en fosfatgrupp på sitt 1-kol. Denna glukos 1-fosfatmolekyl är inte i sig en användbar metabolisk mellanprodukt, men fosfoglukomutas katalyserar omvandlingen av detta glukos 1-fosfat till glukos 6-fosfat (se nedan för mekanismen för denna reaktion).
cellens behov vid den tidpunkt då den genereras. Om cellen har låg energi, kommer glukos 6-fosfat att färdas längs den glykolytiska vägen , vilket så småningom ger två molekyler av adenosintrifosfat . Om cellen är i behov av biosyntetiska intermediärer kommer glukos 6-fosfat in i pentosfosfatvägen, där den kommer att genomgå en serie reaktioner för att ge riboser och/eller NADPH , beroende på cellulära förhållanden.
Om glykogenolys äger rum i levern, kan glukos 6-fosfat omvandlas till glukos av enzymet glukos 6-fosfatas ; glukosen som produceras i levern frigörs sedan till blodomloppet för användning i andra organ. Muskelceller däremot har inte enzymet glukos 6-fosfatas, så de kan inte dela sina glykogenlager med resten av kroppen.
Roll i glykogenes
Fosfoglukomutas verkar också på motsatt sätt när blodsockernivåerna är höga. I detta fall katalyserar fosfoglukomutas omvandlingen av glukos 6-fosfat (som lätt genereras från glukos genom inverkan av hexokinas ) till glukos 1-fosfat.
Detta glukos-1-fosfat kan sedan reagera med UTP för att ge UDP-glukos i en reaktion katalyserad av UDP-glukos-pyrofosforylas . Om det aktiveras av insulin , kommer glykogensyntas att fortsätta att klämma glukos från UDP-glukoskomplexet på en glykogenpolymer.
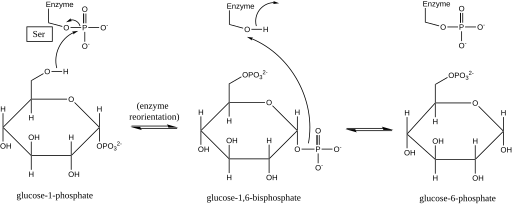
Reaktionsmekanism
Fosfoglukomutas påverkar ett fosforylgruppskifte genom att byta ut en fosforylgrupp med substratet . Isotopmärkningsexperiment har bekräftat att denna reaktion fortskrider genom en glukos-1,6- bisfosfatmellanprodukt .
Det första steget i den framåtriktade reaktionen är överföringen av en fosforylgrupp från enzymet till glukos 1-fosfat, vilket bildar glukos 1,6-bisfosfat och lämnar en defosforylerad form av enzymet. Enzymet genomgår sedan en snabb diffusionsomorientering för att positionera 1-fosfatet i bisfosfatmellanprodukten på rätt sätt i förhållande till det defosforylerade enzymet. Substrat-hastighetsförhållanden och inducerade transporttester har avslöjat att det defosforylerade enzymet sedan underlättar överföringen av en fosforylgrupp från glukos-1,6-bisfosfatintermediären till enzymet, regenererar fosforylerat fosfoglukomutas och ger glukos 6-fos framåtriktningen (info i framåtriktningen). ). Senare strukturella studier bekräftade att det enda stället i enzymet som blir fosforylerat och defosforylerat är syret i serinresten på det aktiva stället (se diagram nedan). En tvåvärd metalljon , vanligtvis magnesium eller kadmium , krävs för enzymatisk aktivitet och har visat sig bilda komplex direkt med fosforylgruppen förestrad till serinet på det aktiva stället .
Denna bildning av en glukos-1,6-bisfosfatintermediär är analog med omvandlingen av 2-fosfoglycerat och 3-fosfoglycerat katalyserad av fosfoglyceratmutas , i vilken 2,3-bisfosfoglycerat genereras som en mellanprodukt.
Strukturera
Medan fosfoglukomutas från kaninmuskel har tjänat som prototyp för mycket av belysningen av detta enzyms struktur, uppvisar nyare bakteriehärledda kristallstrukturer många av samma definierande egenskaper. Varje fosfoglukomutasmonomer kan delas in i fyra sekvensdomäner, I-IV, baserat på enzymets standardspatiala konfiguration (se bilden till höger).
Varje monomer omfattar fyra distinkta α/β-strukturenheter, som var och en innehåller en av de fyra strängarna i varje monomers β-ark och utgörs endast av resterna i en given sekvensdomän (se bilden till höger). Nedgrävningen av det aktiva stället (inklusive Ser-116, den kritiska återstoden på enzymet som är fosforylerat och defosforylerat) i det hydrofoba inre av enzymet tjänar till att utesluta vatten från kontraproduktivt hydrolysera kritiska fosfoesterbindningar samtidigt som det tillåter substratet att komma åt de aktiva webbplats.
Sjukdomsrelevans
Mänsklig muskel innehåller två fosfoglukomutaser med nästan identiska katalytiska egenskaper, PGM I och PGM II. Den ena eller den andra av dessa former saknas hos vissa människor medfödd.
PGM-brist är ett extremt sällsynt tillstånd som inte har en uppsättning välkarakteriserade fysiologiska symtom. Detta tillstånd kan detekteras genom en in vitro- studie av anaerob glykolys som avslöjar en blockering i vägen mot mjölksyraproduktion efter glukos 1-fosfat men före glukos 6-fosfat.
PGM1-brist är känt som CDG-syndrom typ 1t (CDG1T, tidigare känt som glykogenlagringssjukdom typ 14 (GSD XIV).
Gener
Se även
externa länkar
- Fosfoglukomutas vid US National Library of Medicine Medical Subject Headings (MeSH)