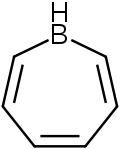
Borepin
|
|
| Namn | |
|---|---|
|
IUPAC namn
^ H -borepin
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Egenskaper | |
| C 6 H 7 B | |
| Molar massa | 89,93 g/mol |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
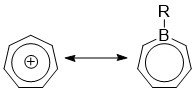
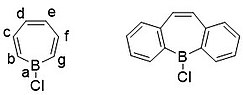
Borepiner är en klass av borinnehållande heterocykler som används i huvudgruppskemi . De består av en sju-ledad omättad ring med en trikoordinat bor i den. Enkla borepiner är analoger av cykloheptatrien , som är en sju-ledad ring som innehåller tre kol-kol dubbelbindningar, som var och en bidrar med 2π elektroner för totalt 6π elektroner . Till skillnad från andra sju-ledade system som silepiner och fosfepiner, har bor en ledig p-orbital som kan interagera med π och π* orbitaler av cykloheptatrien. Detta leder till ett isoelektroniskt tillstånd som liknar det för tropyliumkatjonen , vilket aromatiserar borepinen samtidigt som det låter det fungera som en Lewis-syra . Aromaticiteten , vilket har lett till syntesen av många sammansmälta, π-konjugerade borepinsystem genom åren. Enkla och komplexa borepiner har studerats omfattande på senare tid på grund av deras höga fluorescens och potentiella tillämpningar i teknologier som organiska ljusemitterande dioder ( OLED ) och fotovoltaiska celler .
Syntes
Först rapporterade syntetisk metod
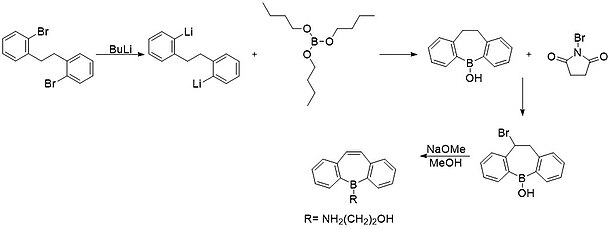
Den första syntesen av en stabil borepin rapporterades 1960 av van Tamelen , Brieger och Untch. Syntesen började med en lithiering av o,o'-dibromobibensyl. Därefter reagerades den med tributylborat för att ge en kondenserad borinsyraring. Denna produkt omsattes med n-bromsuccinimid (NBS) för att ge en bromsubstituerad produkt. Slutligen utförde de en dehydrohalogenering för att ge borepin-ringsystemet som ses ovan. En metod liknande denna som involverar ett tenn-borutbyte används vanligen vid modern syntes av sammansmälta borepinsystem.
Syntetiska utvecklingar
Eisch och Galle isolerade den första icke-fuserade borepinen 1975. Heptafenylborabicykloheptadienen till vänster gick igenom en suprafacial sigmatropisk omarrangering, vilket ledde till mellanprodukten i mitten. Denna mellanprodukt genomgick därefter en disroterande ringöppning för att ge heptafenylborepin till höger. Den isolerade borepinen stabiliseras kinetiskt av de skrymmande fenylgrupperna bundna till alla sju positionerna på ringen, vilket skyddar den från reaktioner med fukt i luften. Men som de flesta borepiner, reagerade denna förening med syre och förvandlades från fluorescerande grönt till lila.
På senare tid utvecklades en metod för en minimalt substituerad borepin av Ashe och Drone. De utgick från 1,2-dibromcyklopenten och utförde en van der Kerk-metod för framställning av borheterocykel. Därefter initierade de en ringförslutning för att bilda ett 7-ledat tennkomplex. Slutligen slutförde de en tenn-borutbytesreaktion för att ha råd med den bicykliska borepinen till höger.
Tidigare syntetiska metoder gav kraftigt substituerade och skrymmande borepinföreningar såsom heptafenylborepin. Dessa vägar, samtidigt som de genererade mycket stabila komplex, gjorde det svårt att analysera egenskaperna hos borepinringen. Minimal substitution gjorde det möjligt för forskare som Ashe att bekräfta närvaron av aromaticitet och ringströmmar i borepinsystemet.
När mer moderna metoder dök upp, har tenn-borutbytesreaktionen blivit mer vanligt förekommande eftersom tenn kan fungera som en platshållare i den sju-ledade ringen, och reagerar med borylhalider ganska lätt.
Isomerisering
Som en sista notering, 2018 syntetiserade Braunschweig -gruppen en valensisomer av borepin, som visas nedan. Denna bicykliska, borinnehållande heterocykel kan omvandlas till sin borepinisomer genom att använda pericykliska , fotokemiska reaktioner.
Reaktivitet
Medan direkt funktionalisering av boratomen är möjlig på grund av dess lediga p-orbital, är de flesta enkla borepiner helt enkelt för reaktiva med luft och fukt för att kunna isoleras. Därför har borepiner stabiliserats med två allmänna metoder: skrymmande, kinetiskt stabiliserande ligander bundna till borcentret och ytterligare aromatiska π-system som kan donera elektrontäthet till den tomma bor-p-orbitalen.
Lewis syra-bas addukter
Borepiner är av intresse på grund av deras Lewis-syra. Density Functional Theory (DFT) beräkningar har visat att HOMO för borepin ligger mestadels med koldelarna i den sju-ledade ringen, medan LUMO är centrerad kring boratomen. Ett exempel på HOMO/LUMO-fördelningen kan ses i figuren nedan.
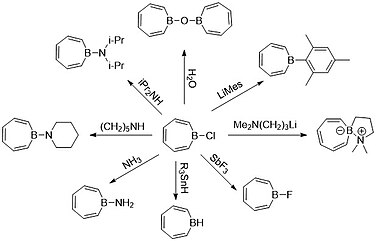
Kemister som Ashe kunde använda denna kunskap på 90-talet för att funktionalisera borepiner som en förening, vilket ledde till bildandet av många Lewis-syrabasaddukter. Den vanligaste borepin-prekursorn som används av kemister är ett borepin-halidkomplex eftersom halogenider är en bra lämnande grupp . Borepin-hydridkomplexet har inte kunnat isoleras på grund av dess instabilitet, medan den bordopade spirocykeln på höger sida uppfyller borens oktett och bildar en zwitterjon mellan bor och kväve.
Borepin-katjoner, anjoner och radikaler
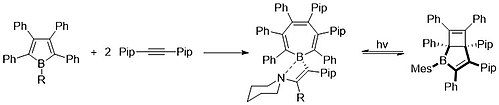
Genom att använda begreppet zwitterioner, Gilliard et. al. kunde nyligen syntetisera och karakterisera ett katjoniskt borepintillstånd med användning av N-heterocykliska karbener (NHC) och cykliska (alkyl)(amino)karbener (CAACS). På grund av dativdonationen av NHC och CAAC har bor bara två kovalenta bindningar, vilket ger det en formell positiv laddning.
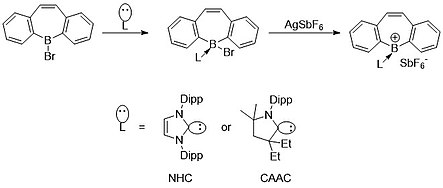
Senast, 2022, Gilliard et. al. kunde tillämpa liknande principer från sina katjoniska borepiner för att bilda och karakterisera den första instansen av isolerade borepinradikaler . Dessa radikaler kunde också reduceras till den första instansen av en borepin- anjon där det finns multipelbindning mellan ett bor-kol-centrum. Genereringen av radikalen kommer från den starka π-accepterande förmågan hos karbenkolet. Elektrondensiteten som delas med bor mitt bak binder något med kolatomen, vilket leder till en-elektronradikalarten.

Rammanipulation
Spektroskopiska data, DFT-beräkningar och termokemiska data har visat att borepin är svagt aromatisk jämfört med tropyliumkatjonen. Denna minskning i aromaticitet leder till ökad reaktivitet och instabilitet i borcentret eftersom det är mindre elektrontäthet som doneras till bors p-orbital.
Som ett resultat sökte kemister sätt att öka den aromatiska karaktären hos borepiner. Den beprövade metoden med vilken kemister stabiliserar borepiner är fenyl-borepin-ringfusion ( annulering ). Tillsatsen av två sammansmälta fenylringar ökar 6π-borepinsystemet till ett 14π-fused system.
En komplikation som uppstår vid sammansmältning av fenylringarna är deras placering. När man syntetiserar dibenso[b,f]borepiner (b är kolet bredvid boratomen) är de perfekt inriktade för konjugering av borcykloheptatrienringen. Men om fenylerna är placerade på ett [c,e]-sätt (se nedan) är den resulterande föreningen mindre stabil än dibenso[b,f]borepiner med cirka 34 kcal/mol, en ganska stor energiskillnad.
Dessa resultat förklarade av Schulman och Disch har använts många gånger för att modifiera borepin-ramverk. Några vanliga exempel inkluderar att öka antalet ringar som gör bornopade polycykliska-aromatiska kolväten (PAH), lägga till ytterligare R-grupper till ramverket såsom alkyner och långkedjiga alkaner och till och med introducera elektronrika heteroatomer som kväve eller svavel för att ytterligare stabilisera borepinerna. Några exempel på dessa föreningar kan ses i bilden nedan:
Den snabba utvecklingen av borepin-stabilisering och funktionalisering sedan 2000-talet har katapulterat studier av komplexa och mångsidiga molekyler. Liksom många andra huvudgruppsföreningar har borepiner funnits i fältet sedan mitten av slutet av 1900-talet men legat vilande tills mer moderna metoder kunde använda dem.
Fotofysiska egenskaper
Fluorescens/fosforescens
De första rapporterna om fluorescens i en borepin publicerades 1975 av Eisch och Galle och beskrev hur heptafenylborepin var fluorescerande grönt när det undersöktes. Små fotofysiska fenomen registrerades under många år, tills Piers grupp publicerade det första exemplet på en blåfluorescerande borepin-art 2009. De upptäckte att genom att expandera π-systemet (dvs. lägga till fler sammansmälta fenylringar) kunde de dramatiskt förändra våglängden på deras föreningar från cirka 250 nanometer (nm) till uppåt 450 nm. Skälet bakom denna förändring är att närvaron av bor i det aromatiska systemet minskar energigapet mellan HOMO och LUMO, vilket resulterar i förändrade absorptioner och högre intensitet av fluorescens. Liknande resultat rapporterades av Caruso, Tovar och Siegler 2010 när de körde borepiner genom elektrokemiska redoxreaktioner och av Messersmith, Siegler och Tovar 2016 när de testade effekterna av varierande aromaticitet hos borepiner.
Den initiala spänningen bakom dessa resultat var potentialen för användning i elektroniska material som organiska lysdioder ( OLED ). Om fluorescens-"omkopplaren" kunde kontrolleras, förutom att ha stabila borepin-komplex, skulle det vara relativt enkelt och billigt att uppnå starkt fluorescerande ljus, potentiellt av vilken färg som helst.
En annan potential för redoxkemi är användningen av borinnehållande polycykliska aromatiska kolväten som halvledare . På grund av borepins lågt liggande LUMO kan den fungera som en elektronacceptor för att delta i elektrontransport. Wagner-gruppen samt Toscano och medarbetare visade beräkningsmässigt och experimentellt de potentiella tillämpningarna för dessa komplex.
Å andra sidan har forskare försökt använda borepiner som potentiella anjonsensorer. Tidigare har tri-koordinatboraner använts för att detektera anjoner som fluorid , cyanid och till och med ammoniak . Forskare som Adachi och Ohshita har visat att vid koordinering av fluorid (F - ) ökar fluorescensen i många magnituder.
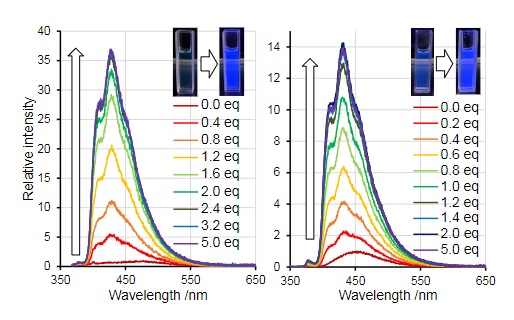
I motsats till det exemplet såg Adachi och Ohshita en förlust av fluorescens vid tillsats av cyanid till en av deras borepin-analoger till tetratienoantracens. Vid kylning förelåg emellertid en märkbar fosforescens i lösningen.
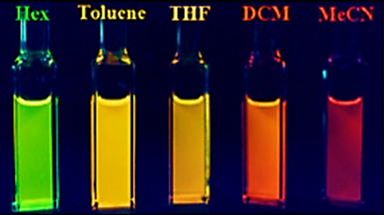
Fluorescens är inte bara begränsad till yttre koordination. Vid införande av kväve i borepin-ringen, Li et. al. kunde observera solvatokroma effekter. Vid tillsats av borepinen till hexaner , toluen , tetrahydrofuran (THF), diklormetan (DCM) och acetonitril (MeCN) observerades ganska drastiska färgförändringar.