Bacillus virus phi29

|
|
| Bacillus virus Φ29 | |
|---|---|
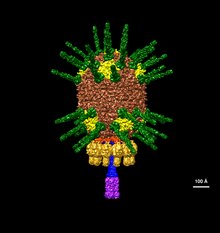
| En illustration av Φ29s huvud baserat på elektronmikroskopidata EMDB-2162 | |
| Virusklassificering | |
| (orankad): | Virus |
| Rike : | Duplodnaviria |
| Rike: | Heunggongvirae |
| Provins: | Uroviricota |
| Klass: | Caudoviricetes |
| Beställa: | Caudovirales |
| Familj: | Salasmaviridae |
| Släkte: | Salasvirus |
| Arter: |
Bacillusvirus Φ29
|
Bacillus virus Φ29 (bakteriofag Φ29) är en dubbelsträngad DNA (dsDNA) bakteriofag med ett prolat icosahedriskt huvud och en kort svans som tillhör släktet Salasvirus , ordningen Caudovirales och familjen Salasmaviridae . De är i samma ordning som fagerna PZA, Φ15, BS32, B103, M2Y (M2), Nf och GA-1. Φ29-fagen upptäcktes först 1965 och är den minsta Bacillus- fagen som hittills isolerats och är bland de minsta kända dsDNA-fagerna.
Φ29 har en unik DNA-förpackningsmotorstruktur som använder prohead packaging RNA (pRNA) för att styra translokationen av faggenomet under replikering . Detta nya struktursystem har inspirerat pågående forskning inom nanoteknik , läkemedelsleverans och terapi .
I naturen infekterar Φ29-fagen Bacillus subtilis , en art av grampositiva , endosporbildande bakterier som finns i marken , såväl som i mag-tarmkanalen hos olika marina och terrestra organismer , inklusive människor .
Historia
År 1965 upptäckte den amerikanske mikrobiologen Dr. Bernard Reilly Φ29-fagen i Dr. John Spizizens labb vid University of Minnesota . På grund av dess ringa storlek och komplexa morfologi har den blivit en idealisk modell för studier av många processer inom molekylärbiologi , såsom morfogenes , viral DNA-förpackning , viral replikation och transkription .
Strukturera
Strukturen av Φ29 är sammansatt av sju huvudproteiner : det terminala proteinet (p3), huvud- eller kapsidproteinet (p8), huvud- eller kapsidfiberproteinet (p8.5), den distala svansknoppen (p9), portalen eller kopplingsprotein (p10), svansröret eller nedre krageproteiner (p11) och svansfibrerna eller bihangsproteinerna (p12*).
Huvudskillnaden mellan Φ29:s struktur och den hos andra fager är dess användning av pRNA i dess DNA-förpackningsmotor.
DNA-förpackningsmotor
Φ29 DNA-paketeringsmotorn paketerar faggenomet i prokapsiden under viral replikation. Φ29 förpackningsmotorn är strukturellt sammansatt av prokapsiden och kopplingsproteinerna, som interagerar med pRNA:t, förpackningsenzymet ( gp16 ) och förpackningssubstratet (genomiskt DNA-gp3). Eftersom processen för genomförpackning är energikrävande , måste den underlättas av en ATP -driven motor som omvandlar kemisk energi till mekanisk energi genom ATP-hydrolys . Φ29 förpackningsmotorn kan generera cirka 57 piconewton (pN) kraft , vilket gör den till en av de mest kraftfulla biomotorerna som studerats hittills.
pRNA
Φ29 pRNA är en mycket mångsidig molekyl som kan polymerisera till dimerer , trimerer , tetramerer , pentamerer och hexamerer . Tidiga studier som Anderson (1990) och Trottier (1998) antog att pRNA bildade intermolekylära hexamerer, men dessa studier hade enbart en genetisk grund snarare än en mikroskopibaserad metod. År 2000 gjorde en studie av Simpson et al. använde kryo-elektronmikroskopi för att bestämma att in vivo endast en pentamer eller mindre polymer kunde rymligt passa in i viruset. I slutändan användes enkel isomorf ersättning med anomal scattering (SIRAS) kristallografi för att bestämma att in vivo -strukturen är en tetramerring. Denna upptäckt stämde överens med vad som var känt om den strukturella geometrin och nödvändiga flexibiliteten hos förpackningsmotorns trevägsövergång. När pRNA är i denna tetramerringform fungerar det som en del av DNA-förpackningsmotorn för att transportera DNA-molekyler till sin destinationsplats i proheadkapseln. Specifikt binder de funktionella domänerna av pRNA till gp16-förpackningsenzymet och den strukturella kopplingsmolekylen för att hjälpa till med translokationen av DNA genom prohead-kanalen. Efter att DNA-förpackningen är klar dissocierar pRNA:t och bryts ned.
Genom och replikation
Φ29-fagen har ett linjärt dsDNA-genom bestående av 19 285 baser . Båda 5'-ändarna av genomet är täckta med ett kovalent bundet terminalt protein (p3) som komplexbinder med DNA-polymeras under replikation.
Φ29 är en av många fager med ett DNA- polymeras som har en annan struktur och funktion jämfört med vanliga DNA-polymeraser i andra organismer. Φ29 bildar ett replikationskomplex som involverar det p3-terminala proteinet, dAMP-nukleotiden och dess eget DNA-polymeras för att syntetisera DNA i en 5'- till 3'- riktning. Denna replikeringsprocess använder också en glidmekanism mot 3'-änden av genomet som använder ett upprepande TTT-motiv för att flytta replikationskomplexet bakåt utan att ändra mallsekvensen. Detta gör att initieringen av DNA-replikation blir mer exakt genom att polymeraskomplexet kontrollerar en specifik sekvens innan förlängningsprocessen påbörjas.
Ansökningar
Nanopartikelsammansättning
Mångsidighet i RNA- struktur och funktion ger möjligheten att sätta ihop nanopartiklar för nanomedicinsk behandling . pRNA:t i bakteriofag Φ29 kan använda sin trevägsövergång för att självmontera till nanopartiklar.
En stor utmaning med att använda pRNA-härledda nanopartiklar är storskalig produktion , eftersom de flesta industrier för närvarande inte är utrustade för att hantera industriell pRNA-syntes. Detta beror främst på att RNA-nanoteknik fortfarande är ett framväxande område som saknar industriell tillämpning och tillverkningsoptimering av små RNA.
Drogleverans
Φ29:s DNA-förpackningssystem, som använder pRNA, innehåller en motor för leverans av terapeutiska molekyler som ribozymer och aptamerer . Den lilla storleken på pRNA-härledda nanopartiklar hjälper också till att leverera läkemedel i trånga utrymmen som blodkärl .
Den största svårigheten med att använda aptamer-baserad läkemedelsleverans är att köpa unika aptamerer och andra multimerer för specifika behandlingar för sjukdomar som potentiellt bryter ned terapeutiska multimerer och nanopartiklar in vivo. Nanopartiklar måste stabiliseras som leveransmekanismer för att anpassa sig till mikromiljöer som kan resultera i förlust av terapeutisk last.
Trippelnegativ bröstcancerbehandling
Trippelnegativ bröstcancer (TNBC) är en aggressiv form av bröstcancer som står för tio till femton procent av alla bröstcancerfall. Kemoterapi är den enda genomförbara nuvarande behandlingen för TNBC eftersom förlusten av målreceptorer som är inneboende i sjukdomen får cancerceller att motstå terapeutiska läkemedel .
Trevägsövergången i Φ29 DNA-förpackningsmotorn kan hjälpa till att sensibilisera TNBC-celler för kemoterapi med hjälp av en siRNA- läkemedelstillförselmekanism för att hämma TNBC-tillväxt och -volym. Denna behandling kan också kombineras med anti-cancerläkemedel som Doxorubicin för att förbättra terapeutiska effekter.