Azo violett

|
|
| Namn | |
|---|---|
|
IUPAC namn
4-[( E )-(4-nitrofenyl)diazenyl]bensen-1,3-diol
|
|
| Andra namn ( E )-4-[(4-nitrofenyl)diazenyl]bensen-1,3-diol 4-(4-nitrofenyl)azobensen-1,3-diol Magneson I p - Nitrofenylazoresorcinol 4-Nitrofenylazoresorcinol |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.735 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C12H9N3O4 _ _ _ _ _ _ _ | |
| Molar massa | 259,318 g mol -1 |
| Utseende | mörkrött till brunt kristallint pulver |
| Densitet | 1,45 g/cm 3 |
| 1 g/ LH2O ; 4 g/L etanol | |
| Faror | |
| Flampunkt | 261,7 °C (503,1 °F; 534,8 K) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
| Azoviolett ( pH-indikator ) | ||
| under pH 11,0 | över pH 13,0 | |
| 11.0 | ⇌ | 13,0 |
Azoviolett ( Magneson I ; p-nitrobenzeneazoresorcinol) är en azoförening med den kemiska formeln C 12 H 9 N 3 O 4 . Det används kommersiellt som ett violett färgämne och experimentellt som en pH-indikator , visas gult under pH 11 och violett över pH 13. Det blir också djupblått i närvaro av magnesiumsalt i en lätt alkalisk eller basisk miljö. citat behövs ] Azoviol kan också användas för att testa förekomsten av ammoniumjoner [ . Färgen på ammoniumklorid eller ammoniumhydroxidlösning kommer att variera beroende på koncentrationen av azoviolett som används. Magneson I används för att testa Be also; den producerar en orangeröd sjö med Be(II) i alkaliskt medium.
Egenskaper
Den intensiva färgen från vilken föreningen fått sitt namn är resultatet av bestrålning och efterföljande excitation och relaxation av det utökade π-elektronsystemet över de RN=NR'-kopplade fenolerna. Absorptionen av dessa elektroner faller i det synliga området av det elektromagnetiska spektrumet . Azoviolens intensiva indigofärg (λ max 432 nm) ungefärligen Pantone R: 102 G: 15 B: 240.
Syntes
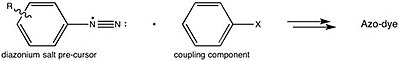
Azoviol kan syntetiseras genom att reagera 4-nitroanilin med salpetersyrlighet (genererad in situ med en syra och ett nitritsalt ) för att producera en diazoniummellanprodukt . Detta reageras sedan med resorcinol , löst i en natriumhydroxidlösning , via en azokopplingsreaktion .
Detta överensstämmer med den generaliserade strategin för framställning av azofärgämnen .
Reaktivitet
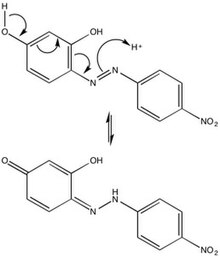
Den kemiska karaktären hos azoviol kan tillskrivas dess azogrupp (-N=N-), sexledade ringar och hydroxylsidogrupper. På grund av steriska repulsioner är azoviolett mest stabil i trans - konfigurationen , men isomerisering av azofärgämnen genom bestrålning är inte ovanligt. Para -position tautomerization av azoviolett ger mekanisk insikt i föreningens beteende i en sur miljö, och därmed dess användning som en grundläggande pH-indikator .
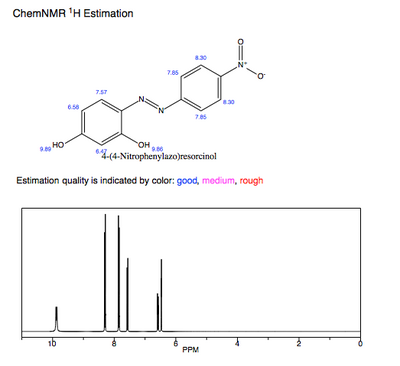
Den förutsagda ' H-NMR av ren azoviolett visar hydroxylprotonerna som de mest avskärmade och sura protonerna. Deltagandet av dessa hydroxylgruppers elektrondonation till det konjugerade π-systemet påverkar likaså azoviolens λ max och p Ka -värde .