3-dimetylaminoakrolein

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
(2E ) -3-(dimetylamino)prop-2-enal |
|
| Andra namn 3-dimetylaminopropenal
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.011.962 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Egenskaper | |
| C 5 H 9 N O | |
| Molar massa | 99,133 g·mol -1 |
| Utseende | Klar, svagt gul till mörkbrun vätska |
| Densitet | 0,99 g· cm -3 vid 25°C |
| Kokpunkt | *91 °C vid 0,1 kPa
|
| Löslig | |
| Löslighet i metanol , 1,2-dikloretan | Löslig |
| Faror | |
| GHS- märkning : | |

|
|
| Fara | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P361 , P50153 , P40153 | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
3-dimetylaminoakrolein är en organisk förening med formeln Me2NC ( H)=CHCHO. Det är en blekgul vattenlöslig vätska. Föreningen har ett antal användbara och ovanliga egenskaper, t.ex. "orsakar den en reversering av den hypnotiska effekten av morfin hos möss" och har en "stimulerande effekt på människor".
Det är en stabil och jämförbart icke-toxisk prekursor för den genotoxiska, mutagena och potentiellt cancerframkallande malondialdehyden . Föreningen kan ses som vinylog dimetylformamid (DMF) och kombinerar funktionaliteterna hos en omättad aldehyd och en enamin. Därför kan 3-dimetylaminoakrolein och vinamidiner härledda därav (bestående av vinylogena amidiner) eller vinamidiniumsalter (substituerade 1,5-diazapentadiener) användas som reaktiva molekylära byggstenar för bildning av kvävehaltiga heterocykler, såsom pyridiner, pyrolesidiner. eller pyrazoler.
Förberedelse
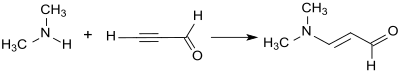
3-Dimetylaminoakrolein erhålls genom tillsats av dimetylamin till trippelbindningen av propynal (propargylaldehyd) via en Reppe -vinylering.
Propynal är emellertid ett olämpligt utgångsmaterial för industriell syntes på grund av dess tendens att explodera. Vinyletrar (som etylvinyleter) är mer lämpade. De reagerar med fosgen och dimetylformamid (som bildar Vilsmeier-reagenset in situ ) i 68 % utbyte till 3-etoxipropenyliden-dimetylammoniumklorid, ett enoleter iminiumsalt. I det svagt alkaliska mediet bildas 3-dimetylaminoakrolein därav, som klyver dimetylamin för att bilda propandial vid exponering för starka baser (såsom natriumhydroxid ).
På en alternativ väg reagerar isobutylvinyleter med iminiumkloriden som härrör från DMF och fosgen . Konverteringen kan genomföras i en kontinuerlig process. Iminiumsaltet ger 3-dimetylaminoakrolein i utspädd natriumhydroxidlösning i 86 % utbyte.
Istället för fosgen kan iminiumsaltet också framställas via en oorganisk syraklorid, såsom fosforyltriklorid eller en organisk syraklorid, såsom oxalylklorid .
Använda sig av
Reaktioner med 3-dimetylaminoakrolein
3-dimetylaminoakrolein kan användas för att introducera omättade och reaktiva C3- grupper i CH-sura och nukleofila föreningar.
Den aktiverade aldehydgruppen av 3-dimetylaminoakrolein reagerar kvantitativt med dialkylsulfater såsom dimetylsulfat. Produkterna är reaktiva men instabila sönderdelas vid 110 °C tillbaka till utgångsmaterialen. Produkterna kan lätt omvandlas med nukleofiler såsom alkoxider eller aminer till motsvarande vinylogena amidacetaler eller amidiner.
Den stabila 3-dimetylaminoakroleindimetylacetalen erhålls genom reaktion med natriummetoxid i 62 % utbyte. 3-Dimetylaminoakrolein kan reageras med CH-sura föreningar (såsom malononitril) till 1,3-butadienderivat eller med cyklopentadien till en aminofulven.
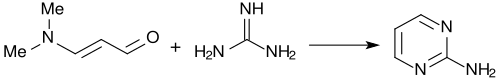
Med guanidin bildar 3-dimetylaminoakrolein nästan kvantitativt 2-aminopyrimidin.
Amidinen som bildas med 2-naftylamin och dimetylsulfataddukten kan cykliseras med natriummetoxid för att ge benso[f]kinolin (1-azafenantren).
N -metylpyrrol bildar 3-(2- N -metylpyrrol)propenalen med 3-dimetylaminoakrolein och POCI3 i 49 % utbyte.
fortskrider framställningen av en mellanprodukt för det kolesterolsänkande läkemedlet fluvastatin via reaktionen av en fluoroaryl-substituerad N -isopropylindol med 3-dimetylaminoakrolein och POCl3 på liknande sätt.
Ibland används iminiumsaltet från reaktionen mellan Vilsmeier-reagenset och vinyletern (en prekursor för 3-dimetylaminopropenal) direkt för syntes, t.ex. för pyrazoler.
När hydrazinhydrat används bildas en pyrazolmoderkropp med 84 % utbyte.
Reaktioner på vinamidiniumsalter
Reaktionen av 3-dimetylaminoakrolein med dimetylammoniumtetrafluorborat producerar praktiskt taget kvantitativt vinamidiniumsaltet 3-dimetylaminoakroleindimetyliminiumtetrafluorborat, som kristalliserar bättre som perkloratsaltet. Saltet reagerar också med cyklopentadien i närvaro av natriumamid i flytande ammoniak för att ge aminofulvenderivatet.
Samma vinamidiniumsalt 1,1,5,5-tetrametyl-1,5-diazapentadieniumklorid bildas också vid reaktionen av 3-dimetylaminoakrolein med dimetylaminhydroklorid i 70 % utbyte. Tvåstegsreaktionen av dimetylamin och 70 % perklorsyra med 3-dimetylaminoakrolein bildar samma iminiumsalt (här hänvisat till som 1,3-bis(dimetylamino)trimetiniumperklorat).
Laktoner (t.ex. y-butyrolakton) eller cykliska ketoner (såsom cyklopentanon) bildar med vinylamidiniumsaltet av 3-dimetylaminoakrolein och dimetylaminhydroklorid motsvarande dienaminoner i 91 % och 88 % utbyte.
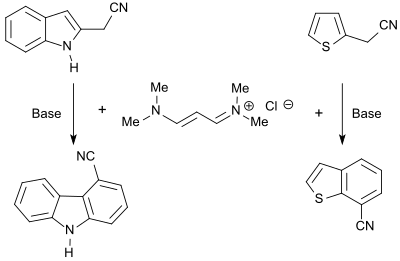
Vinamidiniumsaltet 1,1,5,5-tetrametyl-1,5-diazapentadieniumklorid reagerar med heterocykler som bär CH-sura grupper för att bilda motsvarande dienaminer som kan cykliseras med baser för att bilda kondenserade heteroaromater, såsom karbazoler, bensofuraner eller bensotiofener .
N -alkylpyrroler erhålls i bra utbyte (86%) vid reaktionen av vinamidiniumsaltet med glycinestrar, substituerade tiofener (upp till 87%) i reaktionen med merkaptoättiksyraestrar .
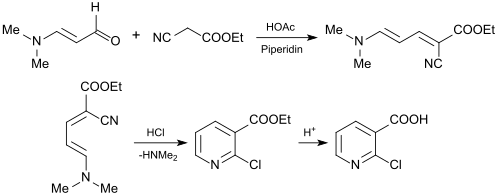
Användningen av 3-dimetylaminoakrolein för syntes av 2-klornikotinsyra (2-CNA) är av industriellt intresse som ett viktigt utgångsmaterial för jordbrukskemikalier och läkemedel. För detta ändamål omsätts 3-dimetylaminoakrolein med cyanesigsäureetylester till 2-klornikotinsäureetylester eller med cyanoättiksyra-n-butylester till 2-klornikotinsäure-n-butylester i en Knoevenagel-reaktion.
De resulterande estrarna av 2-klorpyridinkarboxylsyra kan hydrolyseras jämnt till 2-klornikotinsyra.
Andra reaktioner
Det reagerar svagt alkaliskt och ger med järn(III)klorid en djupröd färg.
Besläktade föreningar
- (Z)-p-aminoakrolein (H2NCH = CHCHO, CAS# 25186-34-9)
- (E)3-(N-Fenyl-N-metyl)aminoakrolein (PhNHCH=CHCHO, CAS# 14189-82-3)
- ^ a b c "3-(dimetylamino)akrolein 927-63-9 | TCI Deutschland GmbH" . www.tcichemicals.com (på tyska) . Hämtad 2018-01-14 .
- ^ a b Sigma-Aldrich Co. , produktnr. 305839 .
- ^ a b c d DE 944852 , F. Wille, "Verfahren zur Herstellung von Derivaten des 3-Amino-acroleins", publicerad 1956-06-28, tilldelad Badische Anilin- & Soda-Fabrik AG
- ^ a b c DE 2424373 , M. Decker, W. Schönleben, H. Toussaint, H. Hoffmann, "Verfahren zur Herstellung von Derivaten des Malondialdehyds", publicerad 1975-12-11, tilldelad BASF AG
- ^ US 5780622 , D. Dolphin, R. Boyle, "Methods of synthesizing 5,15-diarylbenzochlorine-7-one", publicerad 1998-07-14, tilldelad University of British Columbia
- ^ LJ Niederhofer; JS Daniels; CA Rouzer; RE Greene; LJ Marnett (2003), "Malondialdehyd, en produkt av lipidperoxidation, är mutagen i mänskliga celler", J. Biol. Chem. vol. 278, nr. 33, s. 31426–31433, doi : 10.1074/jbc.M212549200 , PMID 12775726
- ^ a b D. Lloyd; H. McNab (1976), "Vinamidine and Vinamidinium-Salze – Beispiele für stabilisierte Push-Pull-Alkene", Angew. Chem. vol. 88, nr. 15, s. 496–504, doi : 10.1002/ange.19760881503
- ^ S. Makhseed; HME Hassaneen; MH Elnagdi (2007), "Studier med 2-(arylhydrazono)aldehyder: syntes och kemisk reaktivitet av mesoxalaldehyd 2-arylhydrazoner och av etyl 2-arylhydrazono-3-oxopropionater" (PDF), Z. Naturforsch . vol. 62b, s. 529–536
- ^ P. Perlmutter (2001), "Propargyl Aldehyde", E-EROS Encyclopedia of Reagents for Organic Synthesis , doi : 10.1002/047084289X.rp262m , ISBN 0471936235
- ^ Z. Arnold; F. Sorm (1958), "Synthetische Reaktionen von Dimethylformamid. I. Allgemeine Synthese von β-Dialdehyden", Collect. tjeckiska. Chem. Commun. (på tyska), vol. 23, nr. 3, s. 452–461, doi : 10.1135/cccc19580452
- ^ DE 19825200 , D. Golsch, M. Keil, H. Isak, "Verfahren zur Herstellung von 3-Aminoacroleinderivaten", publicerad 1999-11-18, tilldelad BASF AG
- ^ H. Bredereck; F. Effenberger; G. Simchen (1963), "Säureamid-Reaktionen, XXXII. Über Säureamid-Dialkylsulfat-Komplexe", Chem. Ber. (på tyska), vol. 96, nr. 5, s. 1350–1355, doi : 10.1002/cber.19630960526
- ^ H. Bredereck; F. Effenberger; D. Zeyfang (1965), "Synthese und Reaktionen vinyloger Amidacetale und Amidine", Angew . Chem. (på tyska), vol. 77, nr. 5, sid. 219, doi : 10.1002/ange.19650770511
- ^ C. Jutz; C. Jutz; RM Wagner (1972), "Die synchrone Sechs-Elektronen-Cyclisierung von Hexatrien-Systemen as neues Syntheseprinzip zur Darstellung von Aromaten und Heteroaromaten", Angew. Chem. (på tyska), vol. 84, nr. 7, s. 299–302, doi : 10.1002/ange.19720840714
- ^ FW Ulrich; E. Breitmeier (1983), "Vinyloge Vilsmeier-Formylierung mit 3-(N,N-Dimethylamino)-acroleinen", Synthesis (på tyska), vol. 1983, nr. 8, s. 641–645, doi : 10.1055/s-1983-30457
- ^ D. Sriram; P. Yogeeswari (2010), Medicinal Chemistry (2:a upplagan), Delhi: Pearson, sid. 364, ISBN 978-81-317-3144-4
- ^ JT Zacharia; T. Tanaka; M. Hagashi (2010), "Enkel och mycket enatioselektiv syntes av (+)- och (-)-fluvastatin och deras analoger", J. Org. Chem. vol. 75, nr. 22, s. 7514–7518, doi : 10.1021/jo101542y , PMID 20939538
- ^ EP 0731094 , H.-J. Wroblowsky, R. Lantzsch, "Verfahren zur Herstellung von Pyrazolen", publicerad 1996-09-11, tilldelad Bayer AG
- ^ Z. Arnold; J. Zemlicka (1960), "Reaktionen der Formamidinium-salze und ihrer Vinyloge mit Carbanionen", Saml. tjeckiska. Chem. Commun. (på tyska), vol. 25, nr. 5, s. 1302–1307, doi : 10.1135/cccc19601302
- ^ V. Nair; CS Cooper (1981), "Kemi av 1,5-diazapentadienium (vinamidinium) salter: alkyleringsreaktioner till multifunktionella dienaminer och dienaminoner", J. Org. Chem. vol. 46, nr. 23, s. 4759–4765, doi : 10.1021/jo00336a027
- ^ Z. Arnold; D. Dvorak; M. Havranek (1996), "Bekväm beredning av 1,3-bis(dimetylamino)trimetiniumperklorat, tetrafluorborat och hexafluorfosfat", Collect. tjeckiska. Chem. Commun. vol. 61, nr. 11, s. 1637–1641, doi : 10.1135/cccc19961637
- ^ V. Nair; CS Cooper (1980), "Selektiva alkyleringsreaktioner med vinamidiniumsalter", Tetrahedron Lett. vol. 21, nr. 33, s. 3155–3158, doi : 10.1016/S0040-4039(00)77433-8
- ^ MT Wright; GD Carroll; TM Smith; SQ Smith (2010), "Synthesis of alkylpyrroles by use of a vinamidinium salt", Tetrahedron Lett. vol. 51, nr. 31, s. 4150–4152, doi : 10.1016/j.tetlet.2010.06.009
- ^ RT Clemens; SQ Smith (2005), "Tillämpningen av vinamidiniumsalter vid syntesen av 2,4-disubstituerade tiofener", Tetrahedron Lett. vol. 46, nr. 8, s. 1319–1320, doi : 10.1016/j.tetlet.2004.12.113
- ^ EP 0372654 , L. Schröder, "Beredning av 2-kloropyridin-3-karboxylsyraestrar", publicerad 1990-06-13, tilldelad Shell Internationale Research Maatschappij BV
- ^ WO 0007989 , D. Golsch, M. Keil, H. Isak, H. Mayer, "Verfahren zur Herstellung von 2-Halogennikotinsäurederivaten und 2-Halogennikotinsäure-n-butylester als Zwischenprodukt", publicerad 2000-02-17, tilldelad BASF AG
- ^ Randolph P. Thummel (2001). "(Z)-p-aminoakrolein". e-EROS Encyclopedia of Reagents for Organic Synthesis . doi : 10.1002/047084289X.ra087 . ISBN 0471936235 .



![Synthese von Benzo[f]chinolin mit 3-Dimethylaminoacrolein](http://upload.wikimedia.org/wikipedia/commons/thumb/6/68/Synthese_von_1-Azaphenanthren.svg/400px-Synthese_von_1-Azaphenanthren.svg.png)