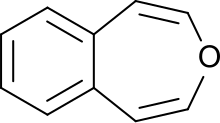
3-bensoxepin
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
3-bensoxepin |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Egenskaper | |
| C10H8O _ _ _ _ | |
| Molar massa | 144,173 g·mol -1 |
| Utseende | Gult fast ämne |
| Smältpunkt | 84 (83–84 °C; 84 °C) |
| Löslighet | löslig i opolära lösningsmedel ( dietyleter , bensen , tetraklormetan ) och alkoholer ( metanol ) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
3-Benzoxepin är ett ringsystem med en aromatisk bensenring och en icke-aromatisk, omättad, syreinnehållande sju-ledad heterocyklisk oxepin . Den första syntesen beskrevs av Karl Dimroth och medarbetare 1961. Det är en av de tre isomererna av bensoxepinerna .
Förekomst och syntes
3-Benzoxepin i sig är en icke-naturlig förening, men det bicykliska ringsystemet är en del av de naturligt förekommande föreningarna perilloxin ( I) från Perilla frutescens (variant acuta ) och tenual (II) och tenucarb (III) från Asphodeline tenuior . Perilloxin hämmar enzymet cyklooxygenas med en IC 50 på 23,2 μM. Icke-steroida antiinflammatoriska läkemedel som acetylsalicylsyra och ibuprofen fungerar också genom att hämma enzymfamiljen cyklooxygenas .
Osubstituerat 3-bensoxepin kan syntetiseras genom en dubbel Wittig-reaktion från o -ftalaldehyd med bis-(α,α'-trifenylfosfonium)-dimetyleter-dibromid. Den senare föreningen kan syntetiseras från a,a'-dibromdimetyleter (bis(bromometyl)eter eller BBME) som är tillgänglig från bromvätesyra , paraformaldehyd och trifenylfosfin . Reaktionen utförs i torr metanol med natriummetoxid, och produkten erhålls i 55 % utbyte.
Föreningen kan också erhållas genom UV-bestrålning av vissa naftalenderivat såsom 1,4-epoxi-1,4-dihydronaftalen.
Det kan också erhållas genom fotooxidation av 1,4-dihydronaftalen, följt av pyrolys av de bildade hydroperoxiderna .
De senare synteserna ger 3-bensoxepiner i låga utbyten (4–6 %).
Egenskaper
3-Benzoxepin är ett ljusgult fast ämne som kristalliseras i blodplättar, med en lukt som liknar naftalen . Materialet är lösligt i opolära, organiska lösningsmedel. Liksom naftalen kan det renas genom sublimering. Det fasta ämnet är relativt syrabeständigt, endast under återflöde i koncentrerade, sura alkohollösningar bildas en omättad aldehyd (troligen en inden -3-aldehyd). Katalytisk hydrering med en palladiumkatalysator resulterar i 1,2,4,5-tetrahydro-3-bensoxepin.
- ^ a b c d Dimroth, K.; Pohl, G. (1961). "3-bensoxepin". Angew. Chem. 73 (12): 436. Bibcode : 1961AngCh..73..436D . doi : 10.1002/ange.19610731215 .
- ^ a b Rosowsky, A., red. (1972). "II. Oxepin ringsystem som innehåller två ringar". Sju-ledade heterocykliska föreningar som innehåller syre och svavel . Heterocykliska föreningars kemi (på tyska). Vol. 26:e. New York: Wiley-Interscience . sid. 96. ISBN 0-471-38210-8 .
- ^ a b c Dimroth, K.; Pohl, G.; Follmann, H. (1966). "Die Synthese von Derivaten des 3-Oxepins und des Furans durch eine zweifache Wittig-Reaktion". Chem. Ber. (på tyska). 99 (2): 634–641. doi : 10.1002/cber.19660990238 .
- ^ a b Liu, J.-H.; Steigel, A.; Reininger, E.; Bauer, R. (2000). "Två nya prenylerade 3-bensoxepinderivat som cyklooxygenashämmare från Perilla frutescens var. acuta ". J. Nat. Driva. 63 (3): 403–405. doi : 10.1021/np990362o . PMID 10757731 .
- ^ Ulubelen, A. ; Tuzlaci, E.; Atilan, N. (1989). "Oxepinderivat och antrakinoner från Asphodeline tenuior och A. taurica ". Fytokemi . 28 (2): 649–650. doi : 10.1016/0031-9422(89)80076-7 .
- ^ Kester, M.; Karpa, KD; Vrana, KE (2011). "NSAID" . Farmakologi . Elseviers integrerade recension. Elsevier Health Sciences . s. 165–166. ISBN 9780323074452 .
- ^ US patent 20040242799 , Grabarnick, M. & Sasson, Y., "Process to bromomethylate aromatic compounds", publicerad 2004-12-02, tilldelad Grabarnick, M. och Sasson, Y.
- ^ a b Ziegler, GR (1969). "Mekanismer för fotokemiska reaktioner i lösning. LVII. Fotoomlagring av 1,4-epoxi-1,4-dihydronaftalen till bens[ f ]oxepin". J. Am. Chem. Soc. 91 (2): 446–449. doi : 10.1021/ja01030a040 .
- ^ Jeffrey, AM; Jerina, DM (1972). "Autoxidation av 1,4-dihydronaftalen. Bildning av 3-bensoxepin via pyrolys av 2-hydroperoxi-1,2-dihydronaftalen". J. Am. Chem. Soc. 94 (11): 4048–4049. doi : 10.1021/ja00766a084 .




