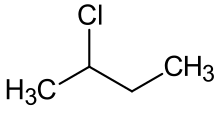
2-klorbutan
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
2-klorbutan |
|
| Identifierare | |
|
|
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.001.047 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII |
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C4H9Cl _ _ _ _ | |
| Molar massa | 92,57 g·mol -1 |
| Densitet | 0,873 g cm −3 |
| Smältpunkt | −140 °C (−220 °F; 133 K) |
| Kokpunkt | 70 °C (158 °F; 343 K) |
| -67,40·10 -6 cm3 / mol | |
| Faror | |
| GHS- märkning : | |
 
|
|
| Fara | |
| H225 , H315 , H319 , H335 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P280 , P302+P352 , P303+P361+P353, P304 +P303 3P , P304+P303 3P , P304+P303+ 21 , P332 + P313 , P337 + P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
2-klorbutan är med formeln C4H9Cl . en förening Det kallas också sek-butylklorid. Det är en färglös, flyktig vätska vid rumstemperatur som inte är blandbar med vatten.
Fysikaliska egenskaper
Det är en färglös, flyktig vätska vid rumstemperatur som inte är blandbar med vatten. Eftersom den är en alkylklorid varierar dess kokpunkt beroende på vilken typ av halogenid som är fäst och var den är fäst. Kokpunkterna för klorider är lägre än bromider eller jodider på grund av den lilla storleken på klor i förhållande till andra halogener och dess svagare intermolekylära krafter.
Trots sin polaritet är 2-klorbutan endast svagt lösligt i vatten på grund av kolvätekedjan som den är fäst vid, vilket gör den löslig i opolära organiska lösningsmedel. Liksom många alkylhalogenider är den relativitetsreaktiv, även om den inte är lika reaktiv som jodider och bromider (I>Br>Cl>F), på grund av denna reaktivitet är alkylfluorider mer stabila än andra och är inte lätt reaktiva.
Syntes
2-klorbutan kan syntetiseras genom tillsats av saltsyra till 2-buten i följande reaktion:
Reaktionen är tvåstegs, där pi-elektronerna angriper kloridväte, som bildar en kloridnukleofil . I det andra steget angriper nukleofilen karbokaten som genereras i det första steget.
Även om tillsats av en vätehalogenid till en alken är stereoselektiv , förhindrar den symmetriska strukturen av 2-buten en anti-Marknikov-produkt från att bildas på grund av att båda sidor av dubbelbindningen har samma stabilitet.
Dessutom kan 2-klorbutan syntetiseras i en substitutionsreaktion genom att reagera 2-butanol med saltsyra.
I detta fall är reaktionen SN1 eftersom 2-butanol genererar en karbokatjon i en 2-stegsreaktion. Eftersom en hydroxylgrupp inte är en bra lämnande grupp, angriper den först kloridvätet och skapar vatten, vilket är en bra lämnande grupp, vilket genererar karbokatjonen. I det andra steget angriper kloridnukleofilen karbokaten för att bilda produkten.
2-klorbutan är tillsammans med andra alkylhalider en användbar mellanprodukt i många olika organiska reaktioner. Halogengruppen är en effektiv lämnande grupp, vilket leder till dess användning i både eliminerings- och substitutionsreaktioner. Dessutom är föreningen också en kandidat för kopplingsreaktioner via ett Grignard-reagens .
Används
2-klorbutan är tillsammans med andra alkylhalider en användbar mellanprodukt i många olika organiska reaktioner. Halogengruppen är en effektiv lämnande grupp, vilket leder till dess användning i både eliminerings- och substitutionsreaktioner. Dessutom är föreningen också en kandidat för kopplingsreaktioner via ett Grignard-reagens.
Substitutionsreaktioner
2-klorbutan är tillsammans med andra alkylhalider en användbar mellanprodukt i många olika organiska reaktioner. Halogengruppen är en effektiv lämnande grupp, vilket leder till dess användning i både eliminerings- och substitutionsreaktioner. Dessutom är föreningen också en kandidat för kopplingsreaktioner via ett Grignard-reagens. I en Sn2-reaktion angriper en nukleofil (jod) det delvis positiva kolet, vilket eliminerar klor. Detta sker i ett steg.
En mindre gynnsam men fortfarande möjlig reaktion är en Snl-reaktion, där en sekundär karbokatjon bildas när den lämnande gruppen avlägsnats. Nukleofilen angriper sedan karbokaten och bildar produkten.
Elimineringsreaktioner
Dessutom, eftersom 2-klorbutan är antiperiplanärt, kan det genomgå E2-elimineringsreaktioner med starka baser. I den avlägsnas den utgående klorgruppen och dubbelbindningen återställs för att ge olika konstitutionella isomerer2. Detta beror på att 2-klorbutan har två olika uppsättningar av β-väte vid det första respektive tredje kolet, vilket resulterar i 1-buten eller 2-buten. Det är viktigt att notera att som en sekundär alkylhalid är både E2- och Sn2-reaktioner lika sannolika när de reagerar med ett ämne som kan fungera som både en bas och en nukleofil. Vilken reaktion som sker beror på omgivningsförhållandena. I en E2-mekanism abstraherar en stark bas (ex. natriumhydroxid) ett betaväte, vilket gör att valen från den tidigare kol-vätebindningen återbildar dubbelbindningen. Denna åtgärd tar bort den lämnande gruppen och omvandlar 2-klorbutan till 2-buten eller 1-buten beroende på vilket betaväte som tas bort, på grund av Zaitsevs regel är den mer stabila 2-butenprodukten att föredra.
Mekanismen för bildandet av 2-buten (gynnas):
Mekanismen för bildandet av 1-buten (inte gynnad):
Grignards reaktioner
Som en alkylhalid kan 2-klorbutan användas för att framställa ett Grignard-reagens för användning vid bildning av en kol-kolbindning. I det första steget donerar en magnesiumjon en elektron till alfakolet i 2-klorbutan, tar bort klor och bildar en allylradikal såväl som en Mg+1-radikal. I det andra steget kopplas Mg+1-radikalen till allylradikalen medan kloridjonen interagerar med magnesiumjonen.


