Värd-gäst kemi
I supramolekylär kemi beskriver värd-gästkemi komplex som är sammansatta av två eller flera molekyler eller joner som hålls samman i unika strukturella förhållanden av andra krafter än de av fullständiga kovalenta bindningar . Värd-gäst kemi omfattar idén om molekylär igenkänning och interaktioner genom icke-kovalent bindning . Icke-kovalent bindning är avgörande för att upprätthålla 3D-strukturen hos stora molekyler, såsom proteiner, och är involverad i många biologiska processer där stora molekyler binder specifikt men övergående till varandra.
Även om icke-kovalenta interaktioner grovt kan delas in i de med mer elektrostatiska eller dispersiva bidrag, finns det få vanliga typer av icke-kovalenta interaktioner: jonbindning , vätebindning , van der Waals-krafter och hydrofoba interaktioner .


Översikt
Värd–gäst kemi är en gren av supramolekylär kemi där en värdmolekyl binder en så kallad gästmolekyl eller jon. De två komponenterna i komplexet interagerar med icke-kovalenta krafter, oftast genom vätebindning . Bindning mellan värd och gäst kan vara mycket selektiv, i vilket fall interaktionen kallas molekylär igenkänning . Ofta finns en dynamisk jämvikt mellan det obundna och det bundna tillståndet:
- H ="värd", G ="gäst", HG ="värd–gästkomplex"
"Värd"-komponenten är ofta den större molekylen, och den omsluter den mindre "gäst"-molekylen. I biologiska system kallas de analoga termerna värd och gäst vanligtvis som enzym respektive substrat .
Termodynamiska principer för interaktioner mellan värd och gäst
Termodynamiken hos värden och gästinteraktionen kan bedömas med NMR-spektroskopi, UV/synlig spektroskopi och isotermisk titreringskalorimetri. Kvantitativ analys av bindningskonstantvärden ger användbar termodynamisk information.
En associationskonstant , kan definieras av uttrycket
där {HG} är komplexets termodynamiska aktivitet vid jämvikt. {H} representerar värdens aktivitet och {G} gästens aktivitet. Storheterna , och är motsvarande koncentrationer och är en kvotient av aktivitetskoefficienter .
I praktiken definieras jämviktskonstanten vanligtvis i termer av koncentrationer.
När denna definition används, antyds det att kvoten av aktivitetskoefficienter har ett numeriskt värde på ett. Det verkar då som att jämviktskonstanten, har dimensionen 1/koncentration, men det kan inte vara sant eftersom standard Gibbs fria energiförändring, är proportionell mot logaritmen för K .
Denna uppenbara paradox löses när dimensionen av { definieras som den ömsesidiga dimensionen av koncentrationskvoten. Innebörden är att anses ha ett konstant värde under alla relevanta experimentella förhållanden. Icke desto mindre är det vanlig praxis att fästa en dimension, såsom millimol per liter eller mikromol per liter, till ett värde på K som har bestämts experimentellt.
Ett stort värde indikerar att värd- och gästmolekyler interagerar starkt för att bilda värd-gäst-komplexet.
Bestämning av bindningskonstantvärden
Enkel värd-gästkomplex
När värd- och gästmolekylerna kombineras för att bilda ett enda komplex, representeras jämvikten som
och jämviktskonstanten, K, definieras som
där [X] anger koncentrationen av en kemisk art X (alla aktivitetskoefficienter antas ha ett numeriskt värde på 1). Massbalansekvationerna, vid vilken datapunkt som helst,
där och representerar de totala koncentrationerna, av värd och gäst, kan reduceras till en enda andragradsekvation i, säg, [G] och så kan lösas analytiskt för ett givet värde på K. Koncentrationerna [H] och [HG] kan sedan härledas.
Nästa steg i beräkningen är att beräkna värdet, för en kvantitet som motsvarar den observerade kvantiteten . Sedan kan en summa av kvadrater, U, över alla datapunkter, np, definieras som
och detta kan minimeras med avseende på stabilitetskonstantvärdet, K, och en parameter såsom den kemiska förskjutningen av arten HG (nmr-data) eller dess molära absorbans (uv/vis-data). Minimeringen kan utföras i ett kalkylprogram som EXCEL genom att använda det inbyggda SOLVER-verktyget.
Denna procedur är tillämplig på 1:1-addukter.
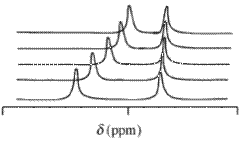
Kärnmagnetisk resonans (NMR) data
Med kärnmagnetisk resonans (NMR)-spektra kommer det observerade kemiska skiftvärdet , δ , som härrör från en given atom som finns i en reagensmolekyl och ett eller flera komplex av det reagenset, att vara det koncentrationsviktade medelvärdet av alla skift av dessa kemiska arter. Kemiskt utbyte antas vara snabbt på NMR-tidsskalan. termer av molfraktioner ,
är det kemiska skiftet av den i: te kemiska arten som innehåller kärnan och är koncentrationen /molfraktionen ( en koncentration / mol dm −3 ) av den arten. Detta uttryck har samma matematiska form som Beers lag . Kemiska skiftvärden kan erhållas för mer än en kärna på ett analogt sätt att absorbansen kan mätas vid mer än en våglängd. Typiska isotoper som kan användas i detta sammanhang är 1 H, 13 C och 31 P. Det är vanligt att använda ett deutererat lösningsmedel vid mätning av 1 H kemiska skiftvärden.
Absorbansdata
Det antas att absorbansen för varje art är proportionell mot koncentrationen av den arten, enligt Beer-Lambert-lagen .
där λ är en våglängd, är den optiska väglängden för kyvetten som innehåller lösningen av N- föreningarna ( kromoforer ), är den molära absorbansen (även känd som extinktionskoefficienten) för den i :te kemiska arten vid våglängden λ, c i är dess koncentration. När koncentrationerna har beräknats enligt ovan och absorbansen har mätts för prover med olika koncentrationer av värd och gäst, ger Beer–Lambert-lagen en uppsättning ekvationer, vid en given våglängd, det som kan lösas med en linjär minsta kvadrater process för de okända extinktionskoefficientvärdena vid den våglängden.
Fluorescensdata
Behandlingen av denna typ av data liknar behandlingen av absorbansdata. Faktum är att ekvationen som definierar sambandet mellan fluorescensintensitet och arternas koncentrationer är mycket lika.
där är fluorescensintensiteten för den i:e arten vid enhetskoncentration.
Kalorimetri
Värmen som utvecklas när en alikvot av värdlösning tillsätts till en lösning som innehåller gästen är summan av bidrag från varje reaktion
där är ett uppmätt värmeförändringsvärde (korrigerat för alla externa värmebidrag) vid datapunkt j , är mängden värme som absorberas eller avges när 1 mol av den i: te reaktionsprodukten bildas och är den faktiska förändringen i antalet mol av den produkten vid det datapunkt. beräknas genom att lösa massbalansekvationerna med givna värden på jämviktskonstanterna. Om jämviktskonstantvärdena är kända kan standardentalpiändringen beräknas genom en linjär minsta kvadraters process, annars måste en icke-linjär metod för dataanpassning användas.
Isotermisk titreringskalorimetri används vanligtvis för att bestämma värdena för både en jämviktskonstant och motsvarande standardreaktionsentalpi. Tillverkarna av ITC-instrument tillhandahåller viss programvara med vilken dessa kvantiteter kan erhållas från experimentella datavärden.
Allmän komplexbildningsreaktion
För varje jämvikt som involverar en värd, H och en gäst G
jämviktskonstanten, , definieras som
Värdena för de fria koncentrationerna, och erhålls genom att lösa massbalansekvationerna med kända eller uppskattade värden för stabilitetskonstanterna.
Sedan kan koncentrationerna av varje komplex art också beräknas som . Förhållandet mellan en arts koncentration och den uppmätta kvantiteten är specifik för mättekniken, som anges i varje avsnitt ovan. Med användning av detta förhållande kan uppsättningen av parametrar, stabilitetskonstantens värden och värden för egenskaper såsom molär absorptionsförmåga eller specificerade kemiska skiftningar, förfinas genom en icke-linjär förfiningsprocess för minsta kvadrater . För en mer detaljerad beskrivning av teorin se Bestämning av jämviktskonstanter . Vissa dedikerade datorprogram finns listade på Implementations .
Bestämning av standardvärden för entalpi och entropiändring
Betrakta först systemet där en lösning innehåller vissa mängder av en värd, H , och en gäst, G , i jämvikt med det enda komplexet HG .
Anta nu att en liten mängd gäst läggs till en blandning av värd och gäst vid jämvikt. En ny jämvikt kommer då att etableras och en mängd värme, Q kommer att utvecklas. När denna mängd har mätts och korrigerats för instrumentella faktorer är den relaterad till förändringen i mängden av det komplexa HG som finns i lösningen.
där Δ H ⊖ är standardentalpin för bildning , det vill säga entalpin för bildning av 1 mol av komplexet, HG och är förändringen i antalet mol av arten HG i lösning.
Om värdet på jämviktskonstanten, är känt, kan kvantiteten beräknas genom att lösa massbalansekvationerna före och efter additionen (se #Simple host –gästkomplex , ovan). Sedan kan värdet på Δ H ⊖ erhållas med metoden för linjär minsta kvadrater som passar ihop med en serie experimentella värden på Q .
Om värdet på K inte är känt måste en icke-linjär förfining av minsta kvadrater utföras för att erhålla de två parametrarna, och . När data erhålls med hjälp av en isotermisk titreringskalorimetri levereras den programvara som krävs för beräkningarna av instrumenttillverkaren.
Notera: användningen av van 't Hoff-ekvationen för att beräkna standardentalpiändringen fasas ut eftersom värdet som erhålls med denna metod sannolikt är föremål för alltför stora fel .
I allmänhet, när m komplex bildas, är värmen som utvecklas vid den k: te "titreringspunkten" summan av bidragen som resulterar från en förändring i koncentrationen av en reaktionsprodukt.
Det finns 2m parameter som ska bestämmas, en standardentalpiändring och en jämviktskonstant för bildningen av varje reaktionsprodukt. Tillverkare av ITC-instrument tillhandahåller några specifika mjukvaruprodukter med vilka flera parametervärden kan beräknas. Datorprogram för det allmänna fallet såsom HypΔH . Affinimeter ITC finns också.
När värdena för varje standardentalpiförändring och jämviktskonstant har bestämts, kan värdet på motsvarande standardentropiförändring härledas från uttrycket
vid den givna temperaturen, T .
Experimentella tekniker
Nukleär magnetisk resonans
Kärnmagnetisk resonans (NMR) används för att studera värd-gästkomplexbildning i lösning. Till exempel kan bindningen av ruteniumtrisbipyridyl -viologen med cucurbituril undersökas genom förskjutningar av viologens protoner.
I många fall är bindningshändelserna mycket snabbare än tidsskalan för datainsamling, i vilket fall utsignalen är en medelvärdessignal för de enskilda molekylerna och komplexet. NMR-tidsskalan är i storleksordningen millisekunder, vilket i vissa fall när bindningsreaktionen är snabb begränsar teknikens noggrannhet.
Ultraviolett-synlig spektroskopi
Ultraviolett-synlig spektroskopi kan användas för att belysa stökiometrier och kinetik för bindningshändelser som värd-gästinteraktionen. använde sig av denna följd för att något modifiera den konventionella Benesi–Hilderbrand-plotten för att få ordningen för komplexbildningsreaktionen mellan bariuminnehållande kroneterbryggad kiral heterotrinukleär salen Zn(II)-komplex (värd) med olika gäster imidazoler och aminosyrametylestrar, tillsammans med de andra parametrarna. De titrerade en fixerad koncentration av zinkkomplexet med varierande mängder av imidazolerna och metylestrarna medan de övervakade förändringarna i absorbansen av pi-till-pi*-övergångsbandet vid 368 nm. Datan passar en modell där förhållandet mellan gäst och värd är 2 i komplexet. De genomförde vidare dessa experiment vid olika temperaturer som gjorde det möjligt för dem att beräkna de olika termodynamiska parametrarna med hjälp av van 't Hoffs ekvation .
Isotermisk titreringskalorimetri
Spektroskopiska tekniker ger information om bindningskonstanten och Gibbs fria energi , . För att få den kompletta uppsättningen termodynamiska parametrar som och , skulle en van 't Hoff-analys med van 't Hoff-ekvationen krävas. De senaste tillkomsterna av kalorimetriska tekniker tillåter dock mätning av och i ett enda experiment, vilket möjliggör bestämning av alla termodynamiska parametrar med hjälp av ekvationen:
förutsatt att experimentet utförs under isotermiska förhållanden; därav namnet isotermisk kalorimetri. Förfarandet liknar ett konventionellt titreringsförfarande där värden tillsätts sekventiellt till gästen och värmen som absorberas eller utvecklas mäts, jämfört med en blanklösning. Den totala värme som frigörs, Q , motsvarar associationskonstanten, Δ med ekvationen:
Vilket kan förenklas som
Var
- = Initial molär koncentration av värden
- = Molar koncentration av gästen
- = kärlets volym
Ovanstående ekvation kan lösas genom icke-linjär regressionsanalys för att erhålla värdet av och och därefter och för den specifika reaktionen. Fördelarna med isotermisk titreringskalorimetri jämfört med andra vanliga tekniker, förutom att ge hela uppsättningen termodynamiska parametrar, är att den är mer allmän och lämpad för ett brett spektrum av molekyler. Det är inte nödvändigt att ha föreningar med kromoforer eller UV-synliga funktionella grupper för att övervaka bindningsprocessen eftersom värmesignalen är en universell egenskap hos bindningsreaktioner. Samtidigt är signal-brusförhållandet ganska gynnsamt vilket möjliggör mer exakt bestämning av bindningskonstanterna, även under mycket utspädda förhållanden. Ett färskt exempel på användningen av denna teknik var för att studera bindningsaffiniteten hos proteinmembranet som omger Escherichia coli till lipofila katjoner som används i läkemedel i olika membranmimetiska miljöer. Motivationen för ovanstående studie var att dessa membran gör bakterierna resistenta mot de flesta föreningar baserade på kvartär ammoniumkatjon, som har de antibakteriella effekterna. Således skulle en förståelse av bindningsfenomenen möjliggöra design av effektiva antibiotika för E. coli . Forskarna bibehöll ett stort överskott av liganden över proteinet för att tillåta bindningsreaktionen att slutföras. Med hjälp av ovanstående ekvationer fortsatte forskarna att beräkna , , och för varje läkemedel i olika miljöer. Data indikerade att läkemedlets bindningsstökiometri med membranet var 1:1 med ett mikromolärt värde på Ka De negativa värdena för , och indikerade att processen var entalpidriven med ett värde på 8–12 kcal/mol för varje läkemedel.
Kooperativitet
I kooperativitet påverkar den initiala ligandbindningen värdens affinitet för efterföljande ligander. Vid positiv kooperativitet ökar den första bindningshändelsen värdens affinitet för en annan ligand. Exempel på positiv och negativ kooperativitet är hemoglobin respektive aspartatreceptor.
På senare år har de termodynamiska egenskaperna hos kooperativitet studerats för att definiera matematiska parametrar som särskiljer positiv eller negativ kooperativitet. Den traditionella Gibbs frienergiekvationen säger: . Men för att kvantifiera kooperativitet i ett värd-gästsystem måste bindningsenergin beaktas. Schemat till höger visar bindning av A, bindning av B, positiv kooperativ bindning av A–B, och slutligen negativ kooperativ bindning av A–B. Därför skulle en alternativ form av Gibbs frienergiekvation vara
var:
- = fri energi för bindning A
- = fri energi för bindning B
- = fri bindningsenergi för A och B tjudrade
- = summan av bindningens fria energier
Det anses att om mer än summan av och , den är positivt samarbetsvillig. Om är mindre, är det negativt samverkande. Värd-gäst kemi är inte begränsad till receptor-ling och interaktioner. Det demonstreras också i jonparningssystem. Under senare år har sådana interaktioner studerats i ett vattenhaltigt medium med användning av syntetiska organometalliska värdar och organiska gästmolekyler. Till exempel är en polykatjonisk receptor som innehåller koppar (värden) koordinerad med molekyler som tetrakarboxylater, trikarballat, aspartat och acetat (gästerna). Denna studie illustrerar att entropi snarare än entalpi bestämmer systemets bindningsenergi som leder till negativ kooperativitet. Den stora förändringen i entropi härrör från undanträngningen av lösningsmedelsmolekyler som omger liganden och receptorn. När flera acetater binder till receptorn frisätter det fler vattenmolekyler till miljön än ett tetrakarboxylat. Detta ledde till en minskning av fri energi vilket tyder på att systemet samarbetar negativt. I en liknande studie, med användning av guanidinium och Cu(II) och polykarboxylatgäster, har det visat sig att positivt kooperativt till stor del bestäms av entalpi. Förutom termodynamiska studier har värd-gästkemi också biologiska tillämpningar.
Ansökningar
Avkänning
Traditionellt har kemisk avkänning använts med ett system som innehåller en kovalent bunden indikator till en receptor genom en länk. När analyten binder ändrar indikatorn färg eller fluorescerar. Denna teknik kallas indikator-spacer-receptor approach (ISR). I motsats till ISR, använder indikator-förskjutningsanalys (IDA) en icke-kovalent interaktion mellan en receptor (värden), indikator och en analyt (gästen). I likhet med ISR använder IDA även kolorimetriska (C-IDA) och fluorescensindikatorer (F-IDA). I en IDA-analys inkuberas en receptor med indikatorn. När analyten tillsätts till blandningen frigörs indikatorn till miljön. När indikatorn släpps ändrar den antingen färg (C-IDA) eller fluorescerar (F-IDA).
IDA erbjuder flera fördelar jämfört med den traditionella ISR-kemiska avkänningsmetoden. För det första kräver det inte att indikatorn är kovalent bunden till receptorn. För det andra, eftersom det inte finns någon kovalent bindning, kan olika indikatorer användas med samma receptor. Slutligen är de medier där analysen kan användas olika.
Kemiska avkänningstekniker som C-IDA har biologiska implikationer. Till exempel protamin ett koagulant som administreras rutinmässigt efter hjärt-lungkirurgi som motverkar den antikoagulerande aktiviteten hos herapin. För att kvantifiera protaminen i plasmaprover används en kolorimetrisk förskjutningsanalys. Azur Ett färgämne är blått när det är obundet, men när det är bundet till herapin visar det en lila färg. Bindningen mellan Azure A och heparin är svag och reversibel. Detta gör att protamin kan tränga undan Azure A. När färgen väl har frigjorts visar den en lila färg. Graden till vilken färgämnet förskjuts är proportionell mot mängden protamin i plasman.
F-IDA har använts av Kwalczykowski och medarbetare för att övervaka aktiviteterna för helicase i E.coli . I denna studie använde de tiazolapelsin som indikator. Helikasen lindar upp dsDNA:t för att göra ssDNA. Fluorescensintensiteten för tiazolorange har en större affinitet för dsDNA än ssDNA och dess fluorescensintensitet ökar när den är bunden till dsDNA än när den är obunden.
Konformationsväxling
Ett kristallint fast ämne har traditionellt sett setts som en statisk enhet där rörelserna av dess atomära komponenter är begränsade till dess vibrationsjämvikt. Som framgår av omvandlingen av grafit till diamant kan omvandling av fast till fast material ske under fysiskt eller kemiskt tryck. Det har nyligen föreslagits att omvandlingen från ett kristallarrangemang till ett annat sker på ett kooperativt sätt. De flesta av dessa studier har fokuserats på att studera ett organiskt eller metallorganiskt ramverk. Förutom studier av makromolekylär kristallin transformation finns det också studier av enkristallmolekyler som kan ändra sin konformation i närvaro av organiska lösningsmedel. Ett organometalliskt komplex har visat sig förvandlas till olika orienteringar beroende på om det utsätts för lösningsmedelsångor eller inte.
Miljöapplikationer
Värd gästsystem har använts för att ta bort farliga material från miljön. De kan göras i olika storlekar och olika former för att fånga en mängd olika kemiska gäster. En tillämpning är förmågan hos p-tert-butycalix[4]aren att fånga en cesiumjon. Cesium-137 är radioaktivt och det finns ett behov av att avlägsna det från kärnavfallet på ett effektivt sätt. Värd-gäst-kemi har också använts för att avlägsna cancerframkallande aromatiska aminer och deras N-nitroso-derivat från vatten. Dessa avfallsmaterial används i många industriella processer och finns i en mängd olika produkter såsom: bekämpningsmedel, läkemedel och kosmetika.


![{\displaystyle K_{a}^{\ominus }={\frac {\{HG\}}{\{H\}\{G\}}}={\frac {[HG]}{[H][G]}}\times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{\displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{\displaystyle K_{a}={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\displaystyle K={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\displaystyle T_{H}=[H]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\displaystyle T_{G}=[G]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\displaystyle [H]=T_{H}-T_{G}+[G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\displaystyle [HG]=K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)




















![{\displaystyle \beta _{pq}={\frac {[H_{p}G_{q}]}{[H]^{p}[G]^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\displaystyle T_{H}=[H]+\sum p\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\displaystyle T_{G}=[G]+\sum q\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\displaystyle [H_{p}G_{q}]=\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)












![{\displaystyle Q={V\Delta H_{0}[H.G]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)

![{\displaystyle Q={\frac {V\Delta H_{0}K_{a}[H_{0}][G]}{1+K_{a}[G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\displaystyle [H_{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)











