Tryptofan 7-halogenas
| Tryptofan 7-halogenasstruktur | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 för Trp 7-halogenas PrnA från PDB 2AQJ-
| |||||||||
| identifierare | |||||||||
| EG nr. | 1.14.19.9 | ||||||||
| CAS-nr. | 198575-11-0 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
Tryptofan 7-halogenas ( EC 1.14.19.9 , PrnA , RebH ) är ett enzym med det systematiska namnet L-tryptofan:FADH2-oxidoreduktas (7-halogenerande) . Detta enzym katalyserar följande kemiska reaktion :
- tryptofan + FADH 2 + Cl − + O 2 + H + 7-klor-L-tryptofan + FAD + 2 H 2 O
Enzymet kan använda bromidjoner (Br − ) i stället för klorid (Cl − ).
Bakgrund
Tryptofan 7-halogenas är en medlem av en klass av enzymer som kallas flavinberoende halogenaser. Före upptäckten av tryptofan 7-halogenas trodde man att alla halogenatomer i metaboliter inkorporerades genom verkan av halogenaser , en annan klass av halogenaser som är beroende av metallcentra som vanadin eller hem , eller perhydrolaser, en klass av halogenaser som genererar persyror som oxiderar i sin tur halogenidjoner till hypohalogena syror, som fungerar som halogeneringsmedel. Dessa enzymer halogenerar utan substratspecificitet och regioselektivitet. Det första tryptofan 7-halogenaset isolerades 1995 av Dairi et al. efter en jämförelse i aminosyrasekvens avslöjade ingen likhet med tidigare kända haloperoxidaser. I motsats till haloperoxidaser är flavinberoende halogenaser mycket smalare i substratomfång och betydligt mer regioselektiva. Andra flavinberoende tryptofanhalogenaser inkluderar tryptofan 5-halogenas och tryptofan 6-halogenas.
Strukturera
protein med 538 rester, 61 kDa . I lösning finns ett antal homologer som homodimerer.
Enzymet har två huvudsakliga bindningsställen: en för FAD och en för tryptofan. Observera att FAD tillförs av ett separat flavinreduktas som kan vara ett allmänt enzym som rekryterats från metabolism eller ett specifikt enzym som kodas i det relevanta biosyntetiska genklustret. Det förstnämnda stället är också reaktionsstället för oxidation av FAD med O 2 . Förbinder dessa två platser är en tunnelliknande struktur cirka 10 Å lång. FAD-bindningsstället binder också en enda kloridjon. Ett kloreringsmedel genereras vid FAD-bindningsstället och kanaliseras sedan genom denna tunnel där det reagerar med substratet tryptofan. Tryptofan är bundet av ett antal interaktioner: andra aromatiska aminosyrarester som tryptofan, fenylalanin och histidin verkar "sandwich" substratet, NH-gruppen av tryptofan bildar vätebindande interaktioner med peptidryggraden i enzymet och aminosyran en del av tryptofan interagerar med närliggande tyrosin- och glutamatrester. Man tror att enzymets regioselektivitet är en konsekvens av tryptofanens rumsliga orientering, med C7 placerad nära änden av tunneln där kloreringsmedlet kommer ut. Flera halogeneringar förhindras eftersom tillsatsen av en halogenatom till substratet kraftigt ökar dess steriska bulk, vilket får det att dissociera från enzymet.
Mekanism
Tryptofan 7-halogenaser är FADH 2- beroende, vilket innebär att de kräver en FADH 2 -kofaktor för att utföra sin reaktion. Flavinreduktaser är ansvariga för omvandlingen av FAD till FADH 2 . För bibehållen aktivitet i en in vitro -miljö kräver således tryptofan 7-halogenaser antingen överskott av FADH 2 eller närvaro av ett flavinreduktas. Eftersom flavinreduktas i sig självt är NAD(P)H -beroende, använde ett färskt arbete som studerade RebH ett kofaktorregenereringssystem där glukosdehydrogenas reducerar NAD(P)+ till NAD(P)H, vilket RebF (RebHs naturliga flavinreduktaspartner) använder för att reducera FAD till FADH 2 för efterföljande användning i RebH:s aktiva plats. Mekanistiskt liknar de flavinberoende halogenaserna flavininnehållande monooxygenaser . I det första steget oxideras FADH 2 av molekylärt syre, vilket genererar en högenergiflavinhydroperoxid.
Vid denna tidpunkt finns det två föreslagna mekanismer för att uppnå halogenering.
I den första angriper flavinhydroperoxid C6-C7-dubbelbindningen av tryptofan och genererar en epoxid . Denna epoxid öppnas sedan genom regioselektiv nukleofil attack av halidanjon vid C7. Den resulterande halohydrinen dehydratiseras för att bilda 7-klorotryptofan. Denna mekanism är tveksam på grund av den långa kanalen som separerar flavinkofaktorn från tryptofansubstratet.

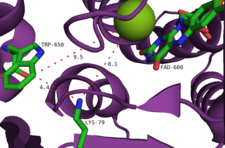
En annan föreslagen mekanism involverar avlyssning av flavinhydroperoxid av en halidanjon, vilket genererar en ekvivalent av hypohalogensyra. Det är osannolikt att denna art är det slutliga halogeneringsmedlet, eftersom experiment har föreslagit att det inte finns någon fri hypohalogensyra som genereras av enzymet. Snarare föreslås det att 10Å-tunneln inom det aktiva stället riktar HOCl mot en lysinrest för att bilda en relativt långlivad kloraminmellanprodukt (halveringstid ~26 timmar). Noterbart är att denna lysinrest (Lys79) är konserverad i alla flavinberoende halogenaser. Kloramin är, även om det är ett svagare halogeneringsmedel, mycket mer selektivt.
Studier indikerar också att en intilliggande glutamatrest är nödvändig för aktivitet - det är troligt att glutamatresten arbetar tillsammans med lysinresten för att generera ett mer lämpligt halogeneringsmedel än en hypohalogensyra. Denna glutamatrest är också konserverad i alla flavinberoende tryptofanhalogenaser. Föreslagna roller för detta glutamat inkluderar en svag interaktion med protonen av hypohalosyra för att öka elektrofilicitet hos kloratomen eller en polarisering av kloratomen (oavsett om den verkliga klorarten är hypohalogensyra eller kloramin) genom glutamats negativt laddade karboxylatgrupp.
Spektroskopiska och kinetiska studier tenderar att stödja denna mekanism. Flavin-redoxkemin visades vara fullständig före klorering; Dessutom kan det inträffa utan tryptofan närvarande, vilket ger förtroende för idén att kloridoxidation och substratklorering är frikopplade processer. Radiomärkning med 36 Cl visar att kloratomen går igenom tre tillstånd i denna halogenering: fri jon, proteinbunden och substratbunden. Dessa data överensstämmer med den föreslagna mekanismen i vilken lysin bildar en kovalent addukt med klorspecies.
I båda fallen överför flavinhydroperoxiden ett syre till reaktanterna. Med eliminering av vatten återställs FAD.
Biologisk relevans
Många medicinskt relevanta föreningar är beroende av tryptofan 7-halogenas i sin biosyntes. Ett anmärkningsvärt exempel är biosyntesen av det svampdödande antibiotikumet pyrrolnitrin i Pseudomonas fluorescens - det var i detta sammanhang som tryptofan 7-halogenas först isolerades. I Lechevalieria aerocolonigenes biosyntesen av antitumörmedlet katalyserar enzymet också det initiala steget i rebeccamycin .
Industriell relevans
I många industrier som jordbrukskemikalier och läkemedel finns det i överflöd av halogenerade kemikalier. Arylhalogenider är också viktiga mellanprodukter i syntesen av andra föreningar på grund av deras mångsidighet i reaktioner som nukleofila aromatiska substitutioner och kopplingsreaktioner . Traditionellt, vid kemisk syntes, halogeneras arener genom elektrofil aromatisk substitution, en process som ofta lider av dålig regioselektivitet och använder toxiska reagens och katalysatorer under hårda reaktionsförhållanden. Tryptofan 7-halogenas kringgår dessa problem, halogenerar dess substrat regioselektivt och använder halogenidsalter och molekylärt syre som reagens vid rumstemperatur och ganska neutralt pH. Följaktligen har mycket forskning ägnats åt att modifiera egenskaper hos tryptofan 7-halogenas för att ändra egenskaper såsom substratomfång, optimal driftstemperatur, termisk stabilitet, regioselektivitet och mer.
Riktad evolution är en särskilt populär metod för att uppnå önskvärda egenskaper. Än så länge har tryptofan 7-halogenas inte isolerats från någon termofil organism, så det var nödvändigt att förstärka enzymets termiska egenskaper med onaturliga medel. Eftersom förhöjda temperaturer tillåter högre reaktionshastigheter är det önskvärt att höja ett enzyms optimala driftstemperatur, men den termiska stabiliteten hos enzymet måste följaktligen förbättras för att förhindra termisk utveckling. Genom riktad evolution uppnåddes framsteg såsom en ökning av T opt från 30-35 °C till 40 °C och en ökning av Tm från 52,4 °C till 70,0 °C. I kombination med riktad evolution genererade substratvandring ett antal enzymer med större substratomfång. Enzymaktivitet utvecklades med ett känt substrat som har strukturell likhet med målsubstratet, sedan är varianter med hög aktivitet med avseende på målsubstratet startpunkter för vidare utveckling. Substrat som var betydligt större än tryptofan kunde halogeneras genom detta tillvägagångssätt. Karvedilol , ett indolderivat med en molmassa på över 400 g mol −1 (jämfört med tryptofans ~200 g mol −1 ), kunde halogeneras av ett utvecklat enzym med hög selektivitet och utbyte och låg enzymbelastning. Dessa resultat tyder på att för större substrat kanske inte hela substratmolekylen är innesluten i det aktiva stället.
Platsstyrd mutagenes har också använts för att utöka substratomfånget. Tryptofansubstrat interagerar med många andra aromatiska aminosyrarester nära bindningsstället, vilket gör det redo för regioselektiv halogenering. Modifiering av dessa rester kan i sin tur tillåta tryptofan att anta olika rumsliga orienteringar som skulle erbjuda alternativa regioselektiviteter.
Naturligt förekommande tryptofan 7-halogenas isolerat från Lechevalieria aerocolonigenes visade sig kunna halogenera naftalenderivat , om än endast i aktiverade positioner, vilket avslöjar att vissa stammar av tryptofan 7-halogenas är ganska breda i substratomfång.
Efter design av ett lämpligt enzym används ett tvärbundet enzymaggregat för reaktion i större skala. Enzymet i sig står inför stabilitetsproblem, men immobilisering genom CLEA kringgår detta problem. Eftersom tryptofan 7-halogenas kräver ett antal partnerenzymer skapades en combiCLEA, där halogenaset är kopplat till hjälpenzymer som flavinreduktas och alkoholdehydrogenas , som är ansvariga för produktionen av FADH 2 respektive NADH. De tre enzymerna fälldes ut med ammoniumsulfat och tvärbands sedan med dialdehyden glutaraldehyd . Låga koncentrationer av glutaraldehyd visade den största aktiviteten, vilket tyder på vikten av lysinresten som omfattas av mekanismdiskussionen, även om det också är känt att höga koncentrationer av glutaraldehyd i allmänhet stör enzymaktiviteten, vilket visades när en separat studie förberedde en klorperoxidasbaserad CLEA. Denna combiCLEA möjliggjorde halogenering i gramskala, och aggregatet erbjöd också förbättrade egenskaper jämfört med det naturliga enzymet såsom återvinningsbarhet, långtidslagringsförmåga och enkel rening.
externa länkar
-
 Media relaterade till Tryptofan 7-halogenas på Wikimedia Commons
Media relaterade till Tryptofan 7-halogenas på Wikimedia Commons - Tryptofan+7-halogenas vid US National Library of Medicine Medical Subject Headings (MeSH)





