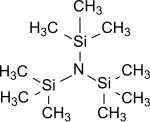
Tris(trimetylsilyl)amin
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
1,1,1-trimetyl- N , N -bis(trimetylsilyl)silanamin |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.014.951 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C9H27NSi 3 _ _ _ _ | |
| Molar massa | 233,57 g/mol |
| Utseende | Vaxartad fast substans |
| Smältpunkt | 67–69°C |
| Kokpunkt | 215°C (85°C vid 13mmHg) |
| Löslighet | Opolära organiska lösningsmedel |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Tris(trimetylsilyl)amin är den enklaste tris(trialkylsilyl)aminen som har den allmänna formeln (R 3Si ) 3N , där alla tre väteatomerna i ammoniaken är ersatta av trimetylsilylgrupper (-Si(CH 3 ) 3 ) . Tris(trimetylsilyl)amin har i flera år legat i centrum för vetenskapligt intresse som en stabil mellanprodukt vid kemisk kvävefixering (dvs omvandlingen av atmosfäriskt kväve N 2 till organiska substrat under normala förhållanden).
Produktion
Tidiga försök att framställa tris(trimetylsilyl)amin från ammoniak och trimetylklorsilan (TMS-Cl) var misslyckade även vid temperaturer på 500 °C och i närvaro av basen pyridin . Reaktionen av ammoniak och trimetylklorsilan stannar vid steget av den dubbelsilylerade produkten bis(trimetylsilyl)amin (vanligtvis hänvisad till som hexametyldisilazan , HMDS).
Tris(trimetylsilyl)amin erhålls genom reaktion av natriumsaltet av hexametyldisilazan - från hexametyldisilazan och natriumamid eller från hexametyldisilazan, natrium och styren - med trimetylklorsilan i 80 % utbyte .
Litiumsaltet av hexametyldisilazan - från hexametyldisilazan och butyllitium eller från hexametyldisilazan och fenyllitium - reagerar med trimetylklorsilan endast i utbyte av 50-60 % till tris(trimetylsilyl)amin.
Reaktionen av litiumnitrid med trimetylklorsilan kan utföras som en enkärlsreaktion i THF med 72 % utbyte.
Egenskaper
Tris(trimetylsilyl)amin är en färglös, kristallin eller vaxartad fast substans som är stabil mot vatten och baser. Alkoholer eller syror klyver dock Si-N-bindningen under bildning av ammoniak.
Ansökningar
Tris(trimetylsilyl)amin som en syntetisk byggsten
Av antimontriklorid och tris(trimetylsilyl)amin kan ett kluster av nitridoantimon-kubantyp bildas nästan kvantitativt vid –60 °C.
Ketoner kan trifluormetyleras i närvaro av P4 , - t - Bu och nonametyltrisilazan under milda förhållanden i utbyten på upp till 84 % med den inerta fluoroformen (HCF3 HFC-23).
Monomeren triklor(trimetylsilyl)-fosforanimin Cl3P = NSiMe3 bildas av tris(trimetylsilyl)amin och fosforpentaklorid i hexan vid 0 °C ,
som kan polymeriseras till linjära polydiklorfosfazener med definierade molekylvikter och polydispersiteter .
Den cykliska trimeren (NPCl 2 ) 3 hexaklorcyklotrifosfan bildas övervägande av tris(trimetylsilyl)amin och fosforpentaklorid i kokande diklormetan (cirka 40 °C) bland andra oligomerer som ger vid upphettning över 250 °C lågmolekylära poly- dikloropho-definierade högmolekylära molekylvikter.
Kvävetrifluorid NF 3 (som används bland annat för plasmaetsning av kiselskivor) kan erhållas från tris(trimetylsilyl)amin och fluor vid –40 °C i acetonitril , vilket undertrycker bildningen av kväve och tetrafluorhydrazin, som produceras som oönskade biprodukter under standardsyntesen av kvävetrifluorid från ammoniak eller ammoniumfluorid .
Tris(trimetylsilyl)aminmellanprodukt vid kemisk kvävefixering
Den tekniska kvävefixeringen möjliggjordes av Haber-Bosch-processen, där kväve omvandlas till ammoniak genom reduktiv protonering i närvaro av järnkatalysatorer under höga tryck (> 150 bar ) och temperaturer (> 400 °C). Vid kemisk kvävefixering (dvs omvandlingen av atmosfäriskt kväve under normala förhållanden till reaktiva utgångsmaterial för kemiska synteser, vanligtvis även ammoniak), spelar tris(trimetylsilyl)amin en viktig roll i den så kallade reduktiva silyleringen, eftersom den hydrolyseras med vatten till ammoniak.
Redan 1895 observerades att metalliskt litium reagerar med kväve till litiumnitrid vid rumstemperatur. 1972 observerade K. Shiina att litium (som elektrondonator ) bildas med trimetylsilylklorid under mörknande tris(trimetylsilyl)amin i närvaro av krom(III)klorid som katalysator vid rumstemperatur med kvävet som används för inertering.
På senare tid, för reduktiv silylering av N2, har natrium använts istället för litium som elektrondonator och molybden- och järnföreningar (såsom pentakarbonyljärn eller ferrocener ) som katalysatorer, upp till 34 ekvivalenter N( Me3Si ) 3 kan erhållas per järnatom i katalysatorn.
Med ett molybden-ferrocenkomplex som katalysator kunde ett omsättningstal på upp till 226 uppnås.
Den katalytiska produktiviteten hos de hittills utvecklade katalysatorerna för kemisk kvävefixering är, trots intensiv forskning, fortfarande i storleksordningen mindre än till exempel de moderna polymerisationskatalysatorerna av metallocentyp eller enzymer .

![{\displaystyle {\begin{matrix}{}\\{\ce {[(CH3)3Si]2NH ->[+{\ce {NaNH2}}][-{\ce {NH3}}] NaN[Si(CH3)3]2 ->[+{\ce {ClSi(CH3)3}}][-{\ce {NaCl}}] N[Si(CH3)3]3}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78549476135b927dc95d6c81bc50de9b89e0b7ae)


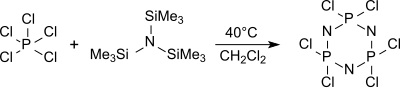

![{\displaystyle {\ce {{N2}+{6e^{-}}->[{\ce {Catalyst:}}\ {\ce {Mo}},\ {\ce {Fe}},\ {\ce {Co}}]}}{\begin{cases}{\ce {->[{\ce {H+}}]}}&{\ce {2NH3}}\\{}\\{\ce {->[{\ce {R3Si-X}}][-\,{\ce {X-}}]}}&{\ce {2N(SiR3)3}}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aa5ae0b13d71a31c97f22297303dee5ed50221a)
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {NavyBlue}{\ce {Li}}}\ {\ce {->[{\ce {CrCl3}}] 2N(SiMe3)3 + 6}}\,{\color {NavyBlue}{\ce {Li}}}{\ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e5556a07b9c108214c4261b7694524d5af5665)
![{\displaystyle {\ce {N2 + 6Me3SiCl + 6}}\,{\color {Red}{\ce {Na}}}\ {\ce {->[{\ce {Fe-catalyst}}] 2N(SiMe3)3 + 6}}\,{\color {Red}{\ce {Na}}}{\ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf55c39b3edb4a67900c2fb80e508b6a1b31d91)
![{\displaystyle {\color {Red}{\ce {N2}}}+{\color {NavyBlue}{\ce {Me3Si}}}{\ce {{Cl}+Na->[{\ce {Mo/Fe-catalyst}}.][{\ce {RT}} \atop (1\ {\ce {atm}})]}}\ {\color {Red}{\ce {N}}}{\color {NavyBlue}{\ce {(Me3Si)3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a412bc2fab4fa67528a1779b7c318068be6f7)