trans- cyklookten
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
( E )-cyklookten |
|
| Andra namn
trans- cyklookten
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| EG-nummer |
|
|
PubChem CID
|
|
|
|
|
|
| Egenskaper | |
| C8H 14 _ _ | |
| Molar massa | 110,200 g·mol -1 |
| Utseende | färglös vätska |
| Densitet | 0,848 g/ml |
| Smältpunkt | −59 °C (−74 °F; 214 K) |
| Kokpunkt | 143°C (1 atm); 68-72 °C (100 torr) |
| Faror | |
| GHS- märkning : | |
 
|
|
| Fara | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
trans -cyklookten är ett cykliskt kolväte med formeln [–(CH 2 ) 6 CH=CH–], där de två C–C enkelbindningarna intill dubbelbindningen finns på motsatta sidor av den senares plan. Det är en färglös vätska med en obehaglig lukt.
Cyklookten är anmärkningsvärt som den minsta cykloalkenen som lätt kan isoleras som sin transisomer . Cis -isomeren är mycket mer stabil ; ringtöjningsenergierna är 16,7 respektive 7,4 kcal/mol.
 |
|
|
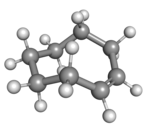
cis -cyklookten i stolskonformation _ |
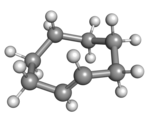
( Rp _ ) -trans - cyklookten i kronkonformation |
Ett plant arrangemang av ringkolen skulle vara för ansträngt, och därför har de stabila konformationerna av transformen en böjd (icke-plan) ring. Beräkningar indikerar att den mest stabila "krona"-konformationen har kolatomerna växelvis ovanför och under ringens plan. En "halvstol"-konformation, med cirka 6 kcal/mol högre energi, har kol 2,3,5,6 och 8 på samma sida av planet av kol 1,4 och 7.
Alla konformationer av trans -cyklookten är kirala (specifikt vad vissa kallar planar-kirala ) och enantiomererna kan separeras. I teorin kan omvandling av mellan enantiomererna göras, utan att bryta några bindningar, genom att vrida hela –CH=CH–-gruppen, stelt, 180 grader. Det innebär dock att ett av dess väten passerar genom den trånga ringen.
Förberedelse
trans -Cyclooctene syntetiserades först i en förberedande skala av Arthur C. Klara av en Hofmann-elimineringsreaktion av N,N,N- trimetylcyklooktylammoniumjodid. Reaktionen ger en blandning av cis- och trans -isomerer, och trans -isomeren fångas selektivt som ett komplex med silvernitrat .
Andra metoder finns där trans- isomeren syntetiseras från cis -isomeren i flera syntessteg. Till exempel kan den framställas i nästan 100 % utbyte genom att omvandla CH3I
cis - isomeren till 1,2-epoxicyklooktan ("cyklooktenoxid") följt av reaktioner med )
litiumdifenylfosfid ( LiPPh2 och med metyljodid . (Liknande förfaranden kan ge cis , trans- isomerer av 1,4-cyklooktadien och 1,5-cyklooktadien) .
Dessutom finns en fotokemisk metod för direkt cis - trans- isomerisering. Även om denna jämvikt starkt gynnar den mer stabila cis- formen, kan reaktionen drivas mot trans- formen genom att fånga med silverjoner.
Reaktioner
På grund av den högre interna spänningen på dubbelbindningen är trans -isomeren mer reaktiv än cis -isomeren och typiska omättade kolväten. Till exempel kommer dess dubbelbindning snabbt att tillsätta tetrazin och dess derivat. Föreningen polymeriserar också lätt med en ruteniumbaserad initiator.