Tetracyanoetylen
|
|
|||

|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
Etenetetrakarbonitril |
|||
| Andra namn TCNE
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.010.527 | ||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C6N4 _ _ _ | |||
| Molar massa | 128,094 g·mol -1 | ||
| Densitet | 1,35 g/cm 3 | ||
| Smältpunkt | 199 °C (390 °F; 472 K) | ||
| Kokpunkt | 130 till 140 °C (266 till 284 °F; 403 till 413 K) 0,1 mmHg ( sublimer ) | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
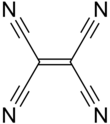
Tetracyanoetylen ( TCNE ) är en organisk förening med formeln C 2 (CN) 4 . Det är ett färglöst fast ämne, även om proverna ofta är benvita. Det är en viktig medlem av cyanokarbonerna .
Syntes och reaktioner
TCNE framställs genom bromering av malononitril i närvaro av kaliumbromid för att ge KBr-komplexet och dehalogenering med koppar .
Oxidation av TCNE med väteperoxid ger motsvarande epoxid , som har ovanliga egenskaper.
I närvaro av bas reagerar TCNE med malononitril för att ge salter av pentacyanopropenid:
Redoxkemi
TCNE är en elektronacceptor . Cyanogrupper har lågenergi π* orbitaler , och närvaron av fyra sådana grupper, med deras π-system (konjugerade) till den centrala C−C dubbelbindningen , ger upphov till en elektrofil alken . TCNE reduceras vid -0,27 V jämfört med ferrocen/ ferrocenium :
På grund av dess förmåga att acceptera en elektron har TCNE använts för att framställa många laddningsöverföringssalter .
Säkerhet
TCNE hydrolyserar i fuktig luft för att ge vätecyanid och bör hanteras därefter.

![{\displaystyle {\ce {C2(CN)2 + CH2(CN)2 -> [(NC)2C-C(CN)-C(CN)2]- + CN- + 2H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ceaeb0ddc1b3471bb32aa0e4bf0e28487ea99bc0)
![{\displaystyle {\ce {C2(CN)4 + e- -> [C2(CN)4]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8bbb6313e3a50673c063acbaae6e8a829da31cd)