Skvalen-hopencyklas
| Skvalen-hopencyklas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
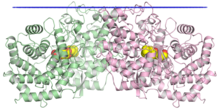 Den kristallografiska strukturen av squalen-hopencyklasdimeren, med membranpositionen indikerad i blått, de två monomererna i grönt och rosa och en substratmimetik i den centrala kaviteten i gult.
| |||||||||
| Identifierare | |||||||||
| EG nr. | 5.4.99.17 | ||||||||
| CAS-nr. | 76600-69-6 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
Skvalen-hopencyklas (SHC) ( EC 5.4.99.17 ) eller hopan-22-ol hydrolyas är ett enzym i familjen terpencyklas /mutas. Det katalyserar omvandlingen av skvalen till pentacykliska triterpener, hopen och hopanol . Detta enzym katalyserar följande kemiska reaktioner.
- squalene hop-22(29)-ene
- squalene + H 2 O hopan-22-ol
, hopanoider, är mycket som steroler i eukaryoter genom att de kondenserar lipidmembran och minskar permeabiliteten. Faktum är att SHC och sterolproducerande enzymer ( oxidosqualencyklas) är evolutionärt relaterade till varandra. Hopanoider antas ge stabilitet vid höga temperaturer och extrem surhet på grund av den stela ringstrukturen. Uppreglering av SHC sker faktiskt i vissa bakterier i närvaro av heta eller sura miljöer. SHC finns mestadels i bakterier, men vissa eukaryoter, såsom svampar och landväxter , är också kända för att ha enzymet.
Introduktion
SHC finns i ett stort antal bakterier men isoleras lättast från den termofila bakterien Alicyclobacillus acidocaldarius .
SHC kräver inte molekylärt syre för sin reaktion och tros vara en evolutionär stamfader till syreberoende oxidosqualencyklas (OSC), som producerar tetracykliska steroler . OSC är en eukaryot analog av SHC och kräver molekylärt syre för dess katalys. Detta kan antyda en senare utveckling av OSC i förhållande till SHC, när atmosfären började ackumulera syre, även om fördelningen av SHC också är begränsad mestadels till aeroba arter.
Strukturera
Skvalen-hopencyklas är ett membranassocierat 70-75 kDa protein som består av 631 aminosyror och sju PTFB-repetitioner. Den existerar som en monotop homodimer.
Mekanism
Bildandet av hopeneskelettet är en av de mest komplexa enstegsreaktionerna inom biokemin. I ett enda steg bryts eller bildas 13 kovalenta bindningar, 9 kirala centra etableras och 5 ringar produceras. Skvalen-hopencyklas katalyserar omvandlingen av den acykliska molekylen skvalen till de pentacykliska triterpenerna av hopen och hopanol. Dessa produkter visas i förhållandet 5:1. Hopene-syntes börjar med att binda squalen i en helt pre-stolkonformation och följs av bildandet av fem CC-bindningar. Dessa sekventiella ringbildande reaktionssteg initieras av en elektrofil attack av en sur proton på en av de två terminala dubbelbindningarna. Den polycykliska bildningen fullbordas när en proton elimineras från den alternativa terminala metylgruppen i skvalen via acceptans av en vattenmolekyl. Denna bas är känd som det främre vattnet . Andra vattenmolekyler arbetar för att förbättra polariseringen ( bakvatten ) och konstruera vätebindningar mellan sju rester-T41, E45, E93, R127, Q262, W133 och Y267. Framvatten spelar också en roll för att bestämma slutprodukten. Om det lagrar protonen som genereras från antingen metylgrupp 29 eller 30 för att bilda hopen. Hopanol produceras dock i mindre mängder om vatten istället för att ta emot protonen bidrar med en hydroxyl till C-22-katjonen i A-ringen.
Under bildandet av ringarna A till D sker mycket liten konformationsförändring. Reaktionen kräver därför ingen mellanprodukt och kan ske i ett steg. Ring E-bildning hindras dock av en entropisk barriär, vilket kan förklara dess frånvaro i de tetracykliska steroiderna .
Aktiv sida
Det aktiva SHC- stället är lokaliserat i en central hålighet inom området för proteinet intill membranet och nås av substratet via en opolär kanal. Den aktiva platsen är särskilt omgiven av aromatiska rester som bildar en hålighet som bekvämt passar skvalenmolekylen när den viks till en produktiv konformation. Den katalytiska mekanismen använder kopplade aspartat- och histidinrester för att initiera cykliseringsreaktionen genom att protonera vid C3 och deprotonera vid C29, fortskridande genom en diskret serie av karbokatationsmellanprodukter . Enzymet kan inaktiveras genom mutation av katalytiska aspartater.
Termodynamik
Detta enzym är ovanligt exotermt med en energifrisättning på 40-50kcal/mol, långt utöver proteinstabiliseringsenergin. Detta antas smälta en lipidsidokanal genom vilken den skrymmande produkten kommer ut. För att bibehålla sin strukturella integritet tror vissa forskare att enzymets 7-8 icke-tandem upprepade QW-motiv (Q är glutamin och W är tryptofan ) som förbinder många α-spiraler på ytan stramar åt proteinstrukturen och förhindrar denaturering.
externa länkar
- Skvalen-hopen+cyklas vid US National Library of Medicine Medical Subject Headings (MeSH)




