Skannande jonkonduktansmikroskopi
Skannande jonkonduktansmikroskopi ( SICM ) är en scanningsprobmikroskopiteknik som använder en elektrod som sondspets. SICM möjliggör bestämning av yttopografin för mikrometer- och även nanometerstrukturer i vattenhaltiga medier som leder elektrolyter. Proverna kan vara hårda eller mjuka, är i allmänhet icke-ledande, och mätningens oförstörande karaktär möjliggör observation av levande vävnader och celler, och biologiska prover i allmänhet.
Den kan upptäcka branta profilförändringar i prover och kan användas för att kartlägga en levande cells styvhet i takt med dess detaljerade topografi, eller för att bestämma cellernas rörlighet under deras migrationer.
Arbetsprincip
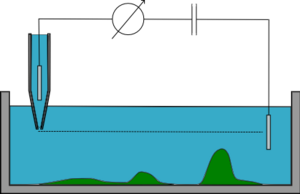
Skanningjonkonduktansmikroskopi är en teknik som använder ökningen av åtkomstmotståndet i en mikropipett i ett elektrolytinnehållande vattenhaltigt medium när den närmar sig en dåligt ledande yta. Den övervakar jonströmmen som flyter in och ut ur mikro/nano-pipetten, vilket hindras om spetsen är mycket nära provytan eftersom gapet genom vilket joner kan strömma minskas i storlek.
SICM-inställningen är generellt följande: En spänning appliceras mellan de två Ag/AgCl-elektroderna, varav den ena är i glasmikropipetten och den andra i bulklösningen. Spänningen kommer att generera en jonström mellan de två elektroderna, som flödar in och ut ur mikropipetten. Konduktansen mellan de två elektroderna mäts och beror på jonflödet.
Pipettens rörelser regleras genom piezoelektrik .
Mikropipetten sänks närmare och närmare provet tills jonflödet börjar begränsas. Systemets konduktans kommer då att minska (och motståndet kommer att öka). När detta motstånd når en viss tröskel stoppas spetsen och positionen registreras. Spetsen flyttas sedan (på olika sätt beroende på vilket läge som används, se nedan) och ytterligare en mätning görs på en annan plats, och så vidare. I slutändan ger en jämförelse av positionerna för alla mätningar en detaljerad höjdprofil av provet.
Det är viktigt att notera att spetsen stoppas innan den kommer i kontakt med provet, så att den inte böjer sig eller skadar den observerade ytan, vilket är en av de största fördelarna med SICM.
Ekvivalent krets
Det totala motståndet för installationen (Rtot) är summan av de tre motstånden: Rb, Rm och Rt. Rb motståndet hos elektrolytlösningen mellan spetsen på mikropipetten och elektroden i huvuddelen av lösningen. Rm är motståndet hos elektrolytlösningen mellan elektroden i mikropipetten och spetsen. Rt är motståndet för strömmen som flyter genom spetsen
Rb och Rm beror på elektrolytens ledningsförmåga och Ag/AgCl-elektrodernas position och form. Rt beror på storleken och formen på öppningen och på avståndet mellan spetsen och provet.
Alla parametrar utom avståndet mellan spetsen och provet är konstanta inom en given SICM-uppställning, så det är variationen av Rt med avståndet till provet som kommer att användas för att bestämma provets topografi.
Vanliga approximationer är: 1) spänningsfallet vid ytorna på Ag/AgCl-elektroderna försummas, det antas att det är försumbart jämfört med spänningsfallet vid spetsen, och konstant, 2) det faktum att bulkresistansen är en funktion av d försummas eftersom det beror på avståndet mellan spetsen och elektroden i bulken.
Jämförelse med andra scanning probe mikroskopitekniker
SICM har en sämre upplösning än AFM eller STM , som rutinmässigt kan nå upplösningar på cirka 0,1 nm. Upplösningen för SICM-mätning är begränsad till 1,5 gånger diametern på spetsöppningen i teorin, men mätningar tagna med en 13 nm öppningsdiameter klarade en upplösning på cirka 3–6 nm.
SICM kan användas för att avbilda dåliga eller icke-ledande ytor, vilket är omöjligt med STM.
Vid SICM-mätningar vidrör inte spetsen av mikropipetten ytan på provet; vilket möjliggör avbildning av mjuka prover (celler, biologiska prover, cellvilli) utan deformation.
SICM används i en elektrolythaltig lösning, så den kan användas i fysiologiska medier och avbilda levande celler och vävnader, och övervaka biologiska processer medan de äger rum.
I hoppläge kan den korrekt bestämma profiler med branta sluttningar och spår.
Bildlägen
Det finns fyra huvudsakliga bildbehandlingslägen i SICM: konstant-z-läge, likströmsläge (konstant avstånd), växelströmsläge och hopp/baksteg/stående inflygningsläge.
Konstant-z-läge
I konstant-z-läge hålls mikropipetten vid en konstant z (höjd) medan den förflyttas i sidled och motståndet övervakas, dess variationer möjliggör rekonstitution av provets topografi. Detta läge är snabbt men används knappt eftersom det bara fungerar på mycket platta prover. Om provet har ojämna ytor kommer pipetten antingen att krascha in i det eller vara för långt för att avbilda större delen av provet.
Likströmsläge
I likströmsläge (DC) (konstant avståndsläge) sänks mikropipetten mot provet tills ett fördefinierat motstånd uppnås. Pipetten flyttas sedan i sidled och en återkopplingsslinga upprätthåller avståndet till provet (genom resistansvärdet). Pipettens z-position bestämmer provets topografi. Detta läge upptäcker inte branta sluttningar i provet, kan komma i kontakt med provet i sådana fall och är benäget att elektroddrift.
Växelströmsläge
I växelströmsläge (AC) oscillerar mikropipetten vertikalt utöver sin vanliga rörelse. Medan pipetten fortfarande är långt från ytan jonströmmen, och motståndet är stadigt, så pipetten sänks. När väl resistansen börjar oscillera, fungerar amplituden som återkoppling för att modulera positionen tills en fördefinierad amplitud uppnås.
AC-komponentens respons ökar mycket brantare än DC, och möjliggör inspelning av mer komplexa sampel.
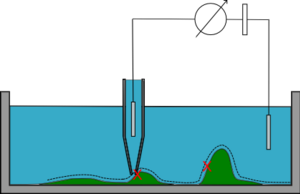
Hoppningsläge
I hoppläge (/backstep/standing approach) sänks mikropipetten till provet tills ett givet motstånd uppnås och höjden registreras. Sedan dras pipetten tillbaka, flyttas i sidled och ytterligare en mätning görs, och processen upprepas. Topografin för provet kan sedan rekonstitueras.
Hoppläget är långsammare än de andra, men kan avbilda komplex topografi och till och med hela celler utan att förvränga provytan. · .
Kombinationer med andra tekniker och alternativa användningsområden
SICM användes för att avbilda en levande neural cell från råtthjärna, bestämma livscykeln för mikrovilli, observera rörelsen av proteinkomplex i spermier.
SICM har kombinerats med fluorescensmikroskopi och förster resonansenergiöverföring.
SICM har använts i en "smart patch-clamp"-teknik, som klämmer pipetten genom sugning mot ytan av en cell och sedan övervakar aktiviteten av natriumkanalerna i cellmembranet.
En kombination av AFM och SICM kunde erhålla högupplösta bilder av syntetiska membran i joniska lösningar.
Scannande närfältsmikroskopi har använts med SICM; SICM-mätningen gjorde det möjligt att placera pipettens spets mycket nära provets yta. Fluorescerande partiklar, som kommer från insidan av mikropipetten, ger en ljuskälla för SNOM som kontinuerligt förnyas och förhindrar fotoblekning.
FSICM (Fast SICM), som framför allt förbättrar hoppningshastigheten, har nyligen utvecklats.