Peptidreceptorradionuklidterapi
| Peptidreceptor radionuklidterapi | |
|---|---|
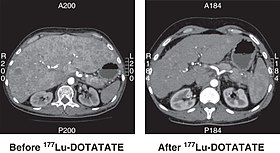 CT-skanning av icke-fungerande pankreatisk NET före och 6 månader efter framgångsrik behandling med fyra cykler av 177 Lu-DOTATATE.
| |
| Specialitet | onkologi |
Peptidreceptorradionuklidterapi (PRRT) är en typ av radionuklidterapi som använder ett radioläkemedel som riktar sig mot peptidreceptorer för att leverera lokal behandling, vanligtvis för neuroendokrina tumörer (NET).
Mekanism
En viktig fördel med PRRT jämfört med andra metoder för strålbehandling är förmågan att rikta leverans av terapeutiska radionuklider direkt till tumören eller målstället. Detta fungerar eftersom vissa tumörer har ett överflöd (överuttryck) av peptidreceptorer, jämfört med normal vävnad. En radioaktiv substans kan kombineras med en relevant peptid (eller dess analog) så att den företrädesvis binder till tumören. Med en gammastrålare som radionuklid kan tekniken användas för avbildning med gammakamera eller PET-skanner för att lokalisera tumörer. När den paras ihop med alfa- eller beta -strålare kan terapi uppnås, som i PRRT.
Den nuvarande generationen av PRRT riktar sig mot somatostatinreceptorer , med en rad analoga material såsom oktreotid och andra DOTA -föreningar. Dessa kombineras med indium-111 , lutetium-177 eller yttrium-90 för behandling. 111 In används främst för enbart avbildning, men utöver dess gammaemission emitteras det även skruvelektroner , vilket kan ha en terapeutisk effekt i höga doser.
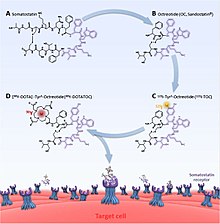
PRRT-radiofarmaka är konstruerade med tre komponenter; radionukliden, kelatorn och somatostatinanalogen (peptid). Radionukliden levererar den faktiska terapeutiska effekten (eller emission, såsom fotoner , för avbildning). Kelateraren är den väsentliga länken mellan radionukliden och peptiden. För 177 Lu och 90 Y är detta vanligtvis DOTA (tetrakarboxylsyra och dess varianter) och DTPA (pentetinsyra) för 111 In. Andra kelatorer kända som NOTA ( triazacyclononane triacetic acid) och HYNIC (hydrazinonicotinamide) har också experimenterats med, om än mer för bildbehandlingstillämpningar. Somatostatinanalogen påverkar biodistributionen av radionukliden, och därmed hur effektivt en behandlingseffekt kan riktas. Förändringar påverkar vilken somatostatinreceptor som är starkast riktad. Till exempel har DOTA- lanreotid (DOTALAN) en lägre affinitet för receptor 2 och en högre affinitet för receptor 5 jämfört med DOTA- oktreotid (DOTATOC).
Ansökningar
Forskningen om effektiviteten av nuvarande PRRT är lovande, men begränsad. Fullständig eller partiell behandlingssvar har setts hos 20-30 % av patienterna i studier som behandlats med 177 Lu - DOTATATE eller 90 Y - DOTATOC , bland de mest använda PRRT-läkemedlen. När det gäller att jämföra dessa två PRRT, Y-märkta och Lu-märkta PRRT:er verkar det som att Y-märkt är mer effektivt för större tumörer, medan Lu-märkt är bättre för mindre och primära tumörer. Bristen på ɤ-emission med Y-märkta PPRT är också en viktig skillnad mellan Lu-peptider och Y-peptid. I synnerhet med Y-märkt PRRT blir det svårt att ställa in en stråldos specifik för patientens behov. I de flesta fall används PRRT för cancer i gastroenteropankreatiska och bronkiala kanalerna, och i vissa fall feokromocytom , paragangliom , neuroblastom eller medullär sköldkörtelkarcinom . Olika tillvägagångssätt för att godkänna effektivitet och begränsa biverkningar undersöks, inklusive radiosensibiliserande läkemedel, fraktioneringsregimer och nya radionuklider. Alfa-emittrar, som har mycket kortare intervall i vävnaden (begränsar effekten på närliggande frisk vävnad), såsom vismut-213 eller aktinium-225 märkt DOTATOC är av särskilt intresse.
En jämförande kohortstudie av 1051 neuroendokrina tumörpatienter som genomgick 90 Y- DOTATOC (n=910) eller 177 Lu-DOTATOC (n=141) rapporterade ingen signifikant skillnad i total överlevnad mellan grupperna. Patienter med hög tumörackumulering och multipla lesioner verkade dock dra nytta av 90 Y- DOTATOC , medan patienter med låg tumörbörda, ensamma lesioner och extrahepatisk sjukdom upplevde mer gynnsamt resultat på 177 Lu-DOTATOC. Det fanns signifikant färre fall av övergående hematotoxicitet i 177 Lu-DOTATOC-gruppen jämfört med 90 Y - DOTATOC- gruppen (1,4 % mot 10,1 %, p=0,001).
Den randomiserade kontrollerade fas III-studien med neuroendokrina tumörer (NETTER-1) utvärderade effektiviteten och säkerheten av 177 Lu-DOTATATE jämfört med högdos oktreotid långverkande repeterbar (LAR) hos patienter med avancerad progressiv somatostatinreceptorpositiva neuroendokrina tumörer i mitten . Patienterna tilldelades slumpmässigt att få antingen 177 Lu-DOTATATE och oktreotid LAR i en dos på 30 mg var fjärde vecka för symtomkontroll (n=116) eller att endast få oktreotid LAR i en dos på 60 mg var fjärde vecka (n=113 , kontrollgrupp). Totalt gick 200 av de 231 patienterna in på långtidsuppföljning. Den slutliga totala överlevnaden i intention-to-treat-populationen var median 48,0 månader i 177 Lu-DOTATATE-gruppen jämfört med median 36,3 månader i kontrollgruppen (p=0,30). Det var med andra ord en numerisk skillnad på 11,7 månader, utan att nå statistisk signifikans. 177 Lu-DOTATATE var associerat med begränsade akuta toxiska effekter. Hos neuroendokrina tumörpatienter med långt framskriden väldifferentierad sjukdom och progression på somatostatinanaloger 177 Lu-DOTATATE sannolikt att minska risken för sjukdomsprogression och vara associerad med livskvalitetsfördelar.
Dosimetri
Terapeutiska PRRT-behandlingar involverar vanligtvis flera gigabecquerel (GBq) aktivitet. Flera radiofarmaka möjliggör samtidig avbildning och terapi, vilket gör det möjligt att göra exakta dosimetriska uppskattningar. Till exempel bremsstrahlung -emissionen från 90 Y och gamma-emissionen från 177 Lu detekteras av en gammakamera. I andra fall kan avbildning utföras genom att märka en lämplig radionuklid till samma peptid som används för terapi. Radionuklider som kan användas för avbildning inkluderar gallium-68 , teknetium-99m och fluor-18 .
För närvarande använda peptider kan resultera i höga njurdoser , eftersom det radioaktiva läkemedlet behålls under relativt långa perioder. Njurskydd används därför i vissa fall i form av alternativa substanser som minskar upptaget av njurarna.
Tillgänglighet
PRRT är ännu inte allmänt tillgängligt, med olika radiofarmaka i olika stadier av kliniska prövningar . Kostnaden för liten volymproduktion av de relevanta radionuklidema är hög. Kostnaden för Lutathera, en kommersiell 177 Lu-DOTATATE-produkt, har angetts av tillverkaren som £71 500 (€80 000 eller $94 000 i juli 2018) för 4 administrationer på 7,4 GBq.
Förenta staterna
177 Lu-DOTATATE ( internationellt icke-proprietärt namn : lutetium ( 177 Lu) oxodotreotid) godkändes av FDA i början av 2018, för behandling av gastroenteropankreatiska neuroendokrina tumörer (GEP-NETs).
Europa
Marknadsföringstillstånd för 177 Lu-DOTATATE beviljades av Europeiska läkemedelsmyndigheten den 26 september 2017. 90 Y-DOTATOC (internationellt icke-proprietärt namn: yttrium ( 90 Y) edotreotid) och 177 Lu-DOTATOC är klassificerade som särläkemedel , men har ännu inte fått försäljningstillstånd.
Storbritannien
rekommenderades lutetium ( 177 Lu) oxodotreotid av NICE för behandling av icke-operabla eller metastaserande neuroendokrina tumörer.
Kalkon
De första behandlingarna i Turkiet med 177 Lu-DOTATATE PRRT utfördes i början av 2014, för behandling av gastroenteropankreatiska neuroendokrina tumörer (GEP-NETs) vid Istanbul University-Cerrahpaşa .
Australien
Forskning i Australien om användningen av lutetium-177-märkta antikroppar för olika cancerformer började vid Department of Nuclear Medicine vid Fremantle Hospital and Health Service (FHHS), Fremantle, Australien i slutet av 1990-talet. De första terapierna i Australien med 177 Lu-DOTATATE PRRT för NET började i februari 2005 på försök enligt Therapeutic Goods Administrations ( TGA ) Special Access Scheme (SAS) och vänlig användning av icke godkända terapeutiska varor. Kort efter detta 177 Lu-DOTATATE PRRT till västra australiensiska NET-patienter rutinmässigt under SAS, såväl som under olika pågående forskningsstudier. [ överdrivet många citat ]
I Australien syntetiserar de flesta centra lutetium-177-peptiden på plats från lutetium-177-klorid och lämplig peptid.
Bieffekter
Liksom alla former av strålbehandling kan joniserande strålning skada frisk vävnad såväl som det avsedda behandlingsmålet. Strålning från lutetium ( 177 Lu) oxodotreotid kan orsaka skada när läkemedlet passerar genom tubuli i njuren. Arginin/lysin kan användas för att minska exponeringen för njurstrålning under peptidreceptorradionuklidbehandling med lutetium ( 177 Lu) oxodotreotid.