Neuroferritinopati
| Neuroferritinopati | |
|---|---|
| Andra namn | Vuxen-debut basal ganglia sjukdom |
 | |
| Cerebellum och basala ganglier | |
| Specialitet |
Neurologi |
Neuroferritinopati är en genetisk neurodegenerativ störning som kännetecknas av ackumulering av järn i basala ganglierna , lillhjärnan och motorisk cortex i den mänskliga hjärnan. Symtom, som är extrapyramidala till sin natur, utvecklas långsamt och blir i allmänhet inte uppenbara förrän i vuxen ålder. Dessa symtom inkluderar chorea , dystoni och kognitiva brister som förvärras med åldern.
Denna störning är autosomalt dominant och orsakas av mutationer i genen som kodar för den lätta kedjans subenhet i ferritinproteinet . Vildtypsferritin fungerar som en buffert för järn, binder det och kontrollerar dess frisättning. Således resulterar mutationer i den lätta kedjan av ferritin i ackumulering av järn i hjärnan som kan avbildas med hjälp av MRI . För närvarande är neuroferritinopati den enda neurodegenerativa sjukdomen med en järnansamling i hjärnan som klassificeras som ett autosomalt dominant syndrom.
Behandling av neuroferritinopati är inriktad på att hantera symtom associerade med chorea och dystoni med hjälp av standardmediciner för var och en. Störningen är progressiv och symtomen blir värre med åldern. Färre än 100 fall av neuroferritinopati har rapporterats sedan dess identifiering 2001. Dess förekomst har till stor del lokaliserats till nordöstra England, vilket tyder på en grundareffekt . På grund av sin genetiska natur är aktuell forskning inriktad på terapeutisk hantering av symtom som orsakas av sjukdomen.
tecken och symtom
Neuroferritinopati har flera utmärkande tecken och symtom. Dessa delas in i två kategorier: diagnostiska fynd och fysiskt synliga symtom.
Diagnostiska fynd
Symtom som kategoriseras som medicinskt testade och diagnostiserade inkluderar järnansamling i hjärnan, basalganglia- kavitation och neurodegeneration . Patienter som diagnostiserats med neuroferritinopati har onormal järnansamling i hjärnan inom neuronerna och glia i striatum och cerebellar cortex. Tillsammans med ackumuleringen av järn i hjärnan orsakar neuroferritinopati vanligtvis också allvarlig neuronförlust. Sekundära symtom kan också uppstå. Det är möjligt att den initiala järnansamlingen kommer att orsaka ytterligare neuronal skada och neuronal död. De skadade neuronerna kan ersättas av andra celler i ett försök att vända neurodegenerationen. Dessa celler har ofta en högre järnhalt. Nedbrytningen av blod-hjärnbarriären kan också uppstå på grund av förlust av neuroner och kommer därefter att tillåta mer järn att komma åt hjärnan och ackumuleras med tiden.
Neuroferritinopati ses främst hos dem som har nått sen vuxen ålder och ses i allmänhet långsamt utvecklas under många decennier under en livstid med medelåldern för debuten är 39 år. En förlust av kognition ses i allmänhet endast med sena stadier av sjukdomen. Diagnostiserade patienter ses behålla det mesta av sin kognitiva funktion tills de mest progressiva stadierna av sjukdomen sätter in.
Fysiska symptom
Symtom som kategoriseras som fysiskt synliga symtom inkluderar korea , dystoni , spasticitet och stelhet , alla fysiska symtom på kroppen förknippade med rörelsestörningar . Symtomen som åtföljer neuroferritinopati som påverkar rörelsen är också progressiva och blir mer generaliserade med tiden. Vanligtvis under de första tio åren av sjukdomsdebut är endast en eller två lemmar direkt påverkade. Utmärkande symtom på neuroferritinopati är chorea, som finns hos 50 % av diagnostiserade patienter, dystoni, som finns hos 43 % av patienterna, och parkinsonism , som finns hos 7,5 % av patienterna. Full kontroll över de övre extremiteterna på kroppen kvarstår i allmänhet tills sjukdomen debuterar sent. Med tiden kan symtom som ses hos en patient ändras från ena sidan av kroppen till den motsatta sidan av kroppen, hoppa från vänster till höger eller vice versa. En annan väg som de fysiskt synliga symtomen har observerats ta är uppkomsten, försvinnandet och sedan återuppträdandet av specifika symptom.
Även om dessa symtom är de klassiska indikatorerna på neuroferritinopati, kommer symtomen att variera från patient till patient.
Orsaker
Neuroferritinopati är ett resultat av onormal järnansamling i hjärnan. Denna järnackumulering beror på mutationer i FTL-polypeptiden, som är ansvarig för att koda för proteiner involverade i järnmetabolism. Neuroferritinopati orsakas oftast av en enda insättning av nukleotiden adenin i genen för L-kedjan ferritin som i sin tur förändrar karboxyländen av hela proteinkedjan. Den exakta platsen för insättningen i exonet varierar dock beroende på familj. Neuroferritinopati kan också orsakas av införandet av två extra nukleotidbaser. Införandet av baser i L-kedjans ferritingenen gör att kedjan förlängs och ändrar sekvensen av aminosyrorna som finns i genen, även känd som en ramförskjutningsmutation .
Dessa mutationer resulterar i minskad järnbindningsförmåga. Den oxidativa skadan som orsakas av ökat järn leder till apoptos eller programmerad celldöd. Ansamling av järn i hjärnan är extremt farlig eftersom överskott av järn katalyserar bildandet av fria radikaler , som har skadliga effekter på hjärnan. Järnackumuleringen som är karakteristisk för neuroferritinopati påverkar särskilt lillhjärnan, basala ganglierna och motoriska cortexregionerna i hjärnan.
Mekanism
Proteinet ferritin fungerar för att binda och frigöra järn, och fungerar som ett järnbuffertsystem i celler. Järn är väsentligt för hjärnans funktion i exempelvis syretransport och cellulär metabolism. Noggrann kontroll av järn är dock viktig eftersom ökade järnnivåer i hjärnan katalyserar bildandet av fria radikaler som skapar oxidativa molekyler via Fenton-reaktionen . Dessa oxidativa molekyler kan orsaka oxidativ hjärnskada. Järn som är bundet till ferritin i icke-reaktivt.
Fenton reaktion
(1) Fe 2+ + H 2 O 2 → Fe 3+ + HO• + OH −
( 2) Fe3 + + H2O2 → Fe2 + + HOO• + H +
Ferritinproteinet är uppbyggt av tung kedja (H) och lätt kedja (L) subenheter. Vid neuroferritinopati är genen som kodar för den lätta kedjan muterad. Flera olika mutationsvariationer har lett till diagnosen neuroferritinopati; alla dessa mutationer förekommer i den lätta kedjan. En muterad lätt kedja tros hämma ferritins förmåga att effektivt binda och hålla järn. Utan kontroll av järn är det fritt fram att orsaka oxidativ hjärnskada enligt beskrivningen ovan.
Koncentrationen av järn i en frisk hjärna varierar mycket från region till region. De specifika regionerna i hjärnan som är associerade med motoriska funktioner verkar ha större ansamlingar av järn än icke-motorrelaterade regioner. Denna observation av varierande järnkoncentrationer är en möjlig förklaring till sambandet mellan rörelsestörningar och järnobalansen i det centrala nervsystemet.
Diagnos
Neuroferritinopati diagnostiseras främst hos äldre vuxna, särskilt hos vuxna som drabbats av Alzheimers sjukdom eller Parkinsons sjukdom , eftersom järn ansamlas i hjärnan under långa tidsperioder. Neuroferritinopati diagnostiseras med antingen neuroimaging teknik, fysiologiska tester eller genetiska tester.
Klassificering
Neuroferritinopati beskrevs ursprungligen med kännetecken för neurodegeneration och järnansamling i hjärnan, vilket ledde till att den klassificerades med andra neurodegeneration med hjärnans järnackumulering ( NBIA) störningar som delar liknande symtom och avbildningsfynd. Med tiden har en enda gen orsaker hittats för många NBIA-störningar, som neuroferritinopati. Innan genetisk testning fanns tillgänglig betraktades alla sådana sjukdomar tillsammans och kallades Hallervorden-Spatz syndrom, en term som inte längre används på grund av namnbrödernas nazistiska partiband. Järnstörningar i hjärnan delas nu in i tre kategorier: genetisk neurodegeneration med järnansamling i hjärnan , genetisk systemisk järnansamling med neurologiska egenskaper och förvärvade sjukdomar associerade med järnöverskott eller järnbrist. Neuroferritinopati klassificeras under den första kategorin. Neuroferritinopati klassificeras som en sent debuterande basalgangliasjukdom och är en dominant ärftlig neurodegenerativ sjukdom. Fyra olika alleler är ansvariga för neuroferritinopati. Tre härrör från nukleotidinsättningar i ferritin lätt kedja (FTL) polypeptidgenen medan den fjärde uppstår från en missense-mutation i FTL-genen.
Neuroimaging
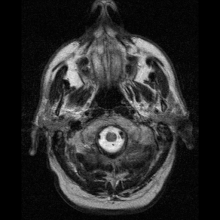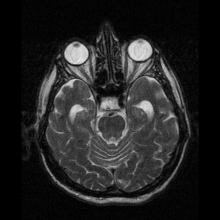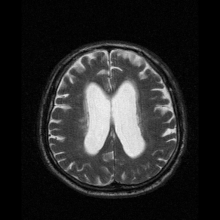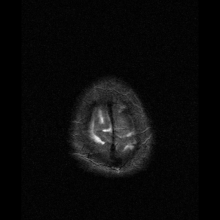
Neuroferritinopati diagnostiseras oftast med MRT och andra neuroavbildningstekniker. MRI hjälper till att identifiera järnavlagringar i lillhjärnan, basala ganglierna och motoriska cortex som är vanliga för neuroferritinopati. MRI av drabbade individer visar också mild cerebellär och cerebral atrofi , eller vävnadsnedbrytning, och gashålighetsbildning i putamen . Viktigast av allt är att MRI visar felveckade ferritinproteiner och järnavlagringar i gliacellerna i caudate-, putamen-, globus pallidus-, hjärnbarken-, thalamus- och purkinjecellerna , vilket orsakar neuronal död i dessa områden.
Fysiologisk testning
Blodprover kommer vanligtvis tillbaka normalt hos drabbade individer, så de fungerar inte som ett pålitligt sätt för diagnos. Blodprov kan visa låga serumferritinnivåer . Detta är dock opålitligt som diagnosmetod, eftersom vissa patienter visar typiska serumferritinnivåer även vid de senaste stadierna av neuroferritinopati. Cerebral spinalvätsketester är också vanligtvis normala. Ferritinaggregat som finns i hud, lever, njure och muskelvävnader kan hjälpa till att diagnostisera neuroferritinopati. Mer cytokrom c-oxidas -negativa fibrer finns också ofta i muskelbiopsierna hos drabbade individer.
Genetisk testning
Genetisk testning kan bekräfta en neuroferritinopatidiagnos. En diagnos kan ställas genom att analysera proteinsekvenserna hos drabbade individer och jämföra dem med kända neuroferritinopatisekvenser.
Behandling
På grund av neuroferritinopatis genetiska etiologi kan sjukdomen för närvarande inte botas. Dessutom kan utvecklingen av sjukdomen inte effektivt stoppas. Därför fokuserar nuvarande behandling på att hantera symtom på sjukdomen. Ingen medicin finns tillgänglig för att behandla alla symtom. Botox har visat sig hjälpa mot fokal dystoni. Dopaminförbrukaren Tetrabenazin har visat sig hjälpa till med ofrivilliga rörelser. Symtom som påverkar rörelsen (dystoni) har också behandlats med L-Dopa , orfenadrin , benshexol , sulpirid , diazepam , klonazepam och deanol . Parkinsonsymtom minskade inte av L-Dopa . Järntillskott bör undvikas.
Epidemiologi
Neuroferritinopati upptäcktes först 2001, och dess första fall rapporterades i Cumbria från norra England. Upptäckten av neuroferritinopati förmedlades av en studie gjord på en stor familj som lider av en dominant ärftlig basalganglisjukdom. Sjukdomen rapporterades vara anstiftad av en mutation på ferritin lätt kedja polypeptid, (FTL1), och visade sig orsaka järnansamling i hjärnan och neurodegeneration. Efter platsen för det första fallet av neuroferritinopati, har majoriteten av patienter som diagnostiserats med sjukdomen också hittats i norra och nordöstra England. Lokaliseringen av majoriteten av fallen till norra och nordöstra England tyder på att en gemensam förfader kan vara ansvarig för många eller möjligen alla fall. Trots att det har rapporterats färre än 100 fall och sjukdomens allmänna läge i norra och nordöstra England, har flera fler fall av neuroferritinopati diagnostiserats runt om i världen under de senaste åren.
Forskning
Nya potentiella behandlingsalternativ som undersöks är venesektion (borttagning av röda blodkroppar), järnkelering med deferipron och koenzym Q10 (ubiquinon) .