Live-cell avbildning

Live-cell imaging är studien av levande celler med hjälp av time-lapse mikroskopi . Det används av forskare för att få en bättre förståelse av biologisk funktion genom studiet av celldynamik. Live-cell imaging var banbrytande under det första decenniet av 2000-talet. En av de första time-lapse mikrocinematografiska filmerna av celler som någonsin gjorts gjordes av Julius Ries, som visar befruktningen och utvecklingen av sjöborreägget . Sedan dess har flera mikroskopimetoder utvecklats för att studera levande celler i större detalj med mindre ansträngning. En nyare typ av avbildning med kvantprickar har använts, eftersom de har visat sig vara mer stabila. Utvecklingen av holotomografisk mikroskopi har bortsett från fototoxicitet och andra färgningshärledda nackdelar genom att implementera digital färgning baserad på cellers brytningsindex.
Översikt
Biologiska system existerar som ett komplext samspel av otaliga cellulära komponenter som interagerar över fyra dimensioner för att producera fenomenet som kallas liv. Även om det är vanligt att reducera levande organismer till icke-levande prover för att rymma traditionella statiska avbildningsverktyg, ju längre provet avviker från de naturliga förhållandena, desto mer sannolikt kommer de känsliga processerna i fråga att uppvisa störningar. Den betungande uppgiften att fånga den sanna fysiologiska identiteten hos levande vävnad kräver därför högupplöst visualisering över både rum och tid inom moderorganismen. De tekniska framstegen inom levande cellavbildning, utformad för att ge rumsliga bilder av subcellulära händelser i realtid, tjänar en viktig roll för att bekräfta den biologiska relevansen av fysiologiska förändringar som observerats under experiment. På grund av deras sammanhängande samband med fysiologiska förhållanden, anses levande cellanalyser vara standarden för att sondera komplexa och dynamiska cellulära händelser. När dynamiska processer som migration , cellutveckling och intracellulär trafficking alltmer blir fokus för biologisk forskning, kommer tekniker som kan fånga 3-dimensionell data i realtid för cellulära nätverk ( in situ ) och hela organismer ( in vivo ) att bli oumbärliga verktyg att förstå biologiska system. Den allmänna acceptansen av levande cellavbildning har lett till en snabb ökning av antalet utövare och etablerat ett behov av ökad rumslig och tidsmässig upplösning utan att äventyra cellens hälsa.
Typer av mikroskopi som används
Faskontrast
Innan introduktionen av faskontrastmikroskopet var det svårt att observera levande celler. Eftersom levande celler är genomskinliga måste de färgas för att vara synliga i ett traditionellt ljusmikroskop . Tyvärr dödar processen att färga celler i allmänhet dem. Med uppfinningen av faskontrastmikroskopin blev det möjligt att observera ofärgade levande celler i detalj. Efter introduktionen på 1940-talet blev levande cellavbildning snabbt populärt med hjälp av faskontrastmikroskopi. Faskontrastmikroskopet populariserades genom en serie time-lapse-filmer (se video), inspelade med en fotografisk filmkamera. Dess uppfinnare, Frits Zernike , tilldelades Nobelpriset 1953. Andra senare faskontrasttekniker som används för att observera ofärgade celler är Hoffman-modulation och differentiell interferenskontrastmikroskopi .
Fluorescerande
Faskontrastmikroskopi har inte kapacitet att observera specifika proteiner eller andra organiska kemiska föreningar som bildar en cells komplexa maskineri. Syntetiska och organiska fluorescerande fläckar har därför utvecklats för att märka sådana föreningar, vilket gör dem observerbara med fluorescerande mikroskopi (se video). Fluorescerande fläckar är dock fototoxiska , invasiva och blekande när de observeras. Detta begränsar deras användning när man observerar levande celler under längre tidsperioder. Icke-invasiva faskontrasttekniker används därför ofta som ett viktigt komplement till fluorescerande mikroskopi i levande cellavbildningstillämpningar.
Kvantitativ faskontrast
Som ett resultat av den snabba ökningen av pixeltätheten hos digitala bildsensorer har kvantitativ faskontrastmikroskopi dykt upp som en alternativ mikroskopimetod för avbildning av levande celler. Kvantitativ faskontrastmikroskopi har en fördel framför fluorescerande och faskontrastmikroskopi genom att den är både icke-invasiv och kvantitativ till sin natur.
På grund av det smala fokaldjupet hos konventionell mikroskopi är avbildning av levande celler för närvarande i stor utsträckning begränsad till att observera celler på ett enda plan. De flesta implementeringar av kvantitativ faskontrastmikroskopi tillåter att skapa och fokusera bilder på olika fokalplan från en enda exponering. Detta öppnar upp för den framtida möjligheten för 3-dimensionell avbildning av levande celler med hjälp av fluorescenstekniker. Kvantitativ faskontrastmikroskopi med rotationsskanning gör att 3D-time-lapse-bilder av levande celler kan förvärvas med hög upplösning.
Holotomografi
Holotomografi (HT) är en laserteknik för att mäta tredimensionellt brytningsindex (RI) tomogram av ett mikroskopiskt prov såsom biologiska celler och vävnader. Eftersom RI kan fungera som en inneboende bildkontrast för transparenta eller fasobjekt, kan mätningar av RI-tomogram ge etikettfri kvantitativ avbildning av mikroskopiska fasobjekt. För att mäta 3D RI-tomogram av prover använder HT principen om holografisk avbildning och omvänd spridning . Vanligtvis mäts flera holografiska 2D-bilder av ett prov vid olika belysningsvinklar, med användning av principen för interferometrisk avbildning. Sedan rekonstrueras ett 3D RI-tomogram av provet från dessa multipla 2D holografiska bilder genom att omvänt lösa ljusspridning i provet.
Principen för HT är mycket lik röntgendatortomografi (CT), eller CT-skanning . CT-skanning mäter flera 2D-röntgenbilder av en människokropp vid olika belysningsvinklar, och ett 3D-tomogram (röntgenabsorptionsförmåga) hämtas sedan med hjälp av teorin om omvänd spridning. Både röntgen-CT och laser HT delar samma styrande ekvation - Helmholtz-ekvationen , vågekvationen för en monokromatisk våglängd. HT är också känd som optisk diffraktionstomografi.
Kombinationen av holografi och rotationsskanning möjliggör långvariga, etikettfria, live-cellinspelningar.
Icke-invasiv optisk nanoskopi kan uppnå en sådan lateral upplösning genom att använda ett kvasi- 2π -holografiskt detektionsschema och komplex dekonvolution. De rumsliga frekvenserna för den avbildade cellen har ingen mening för det mänskliga ögat. Men dessa spridda frekvenser omvandlas till ett hologram och syntetiserar ett bandpass, som har en upplösning som är dubbelt så hög som normalt tillgänglig. Hologram registreras från olika belysningsriktningar på provplanet och observerar sub-våglängds tomografiska variationer av provet. Nanoskaliga öppningar tjänar till att kalibrera den tomografiska rekonstruktionen och att karakterisera bildsystemet med hjälp av den koherenta överföringsfunktionen. Detta ger upphov till realistisk omvänd filtrering och garanterar verklig komplex fältrekonstruktion.
Sammanfattningsvis är de två terminologierna (i) optisk upplösning (den riktiga) och (ii) samplingsupplösning (den på skärmen) separerade för 3D-holotomografisk mikroskopi.
Instrumentering och optik
Live-cell imaging representerar en noggrann kompromiss mellan att få den högsta upplösta bilden och att hålla cellerna vid liv så länge som möjligt. Som ett resultat möter mikroskopister med levande celler en unik uppsättning utmaningar som ofta förbises när de arbetar med fixerade prover. Dessutom använder live-cell imaging ofta speciella optiska system och detektorspecifikationer. Till exempel, idealiskt skulle mikroskopen som används i levande cellavbildning ha höga signal-till-brus-förhållanden , snabba bildupptagningshastigheter för att fånga time-lapse-video av extracellulära händelser och upprätthålla cellernas långsiktiga livskraft. Att optimera även en enda aspekt av bildinsamling kan dock vara resurskrävande och bör övervägas från fall till fall.
Linsdesigner
Låg förstoring "torr"
I fall där extra utrymme mellan objektivet och provet krävs för att arbeta med provet, kan en torr lins användas, vilket eventuellt kräver ytterligare justeringar av korrigeringskragen, vilket ändrar linsens placering i objektivet, för att ta hänsyn till skillnader i bildkammare. Specialobjektivlinser är designade med korrigeringskragar som korrigerar för sfäriska aberrationer samtidigt som det tar hänsyn till täckglasets tjocklek. I torra objektivlinser med hög numerisk bländaröppning (NA) ändrar justeringsringen för korrigeringskragen positionen för en rörlig linsgrupp för att ta hänsyn till skillnader i hur utsidan av objektivet fokuserar ljuset i förhållande till mitten. Även om linsavvikelser är inneboende i alla linsdesigner, blir de mer problematiska i torra linser, där upplösningsbevarande är nyckeln.
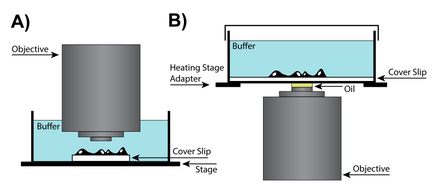
Olje-immersion hög-NA
Oljenedsänkning är en teknik som kan öka bildupplösningen genom att sänka ner linsen och provet i olja med ett högt brytningsindex . Eftersom ljus böjs när det passerar mellan medier med olika brytningsindex, genom att placera olja med samma brytningsindex som glas mellan linsen och objektglaset, kan två övergångar mellan brytningsindex undvikas. För de flesta applikationer rekommenderas dock att oljedoppning används med fasta (döda) prover eftersom levande celler kräver en vattenhaltig miljö och blandning av olja och vatten kan orsaka allvarliga sfäriska avvikelser. För vissa applikationer silikonolja användas för att producera mer exakta bildrekonstruktioner. Silikonolja är ett attraktivt medium eftersom den har ett brytningsindex som ligger nära det för levande celler, vilket gör det möjligt att producera högupplösta bilder samtidigt som den minimerar sfäriska aberrationer.
Vattennedsänkning
Live-cell imaging kräver ett prov i en vattenhaltig miljö som ofta är 50 till 200 mikrometer bort från täckglaset. Därför kan vattendoppande linser hjälpa till att uppnå en högre upplösningsförmåga på grund av att både miljön och själva cellerna kommer att vara nära vattnets brytningsindex. Vattendoppande linser är designade för att vara kompatibla med vattens brytningsindex och har vanligtvis en korrigerande krage som tillåter justering av objektivet. Dessutom, på grund av det högre brytningsindexet för vatten, har vattendoppande linser en hög numerisk bländare och kan producera bilder överlägsna oljedoppande linser vid upplösning av plan som är djupare än 0 µm.
Doppning
En annan lösning för levande cellavbildning är dopplinsen. Dessa linser är en delmängd av vattendoppande linser som inte kräver täckglas och som kan doppas direkt i provets vattenhaltiga miljö. En av de främsta fördelarna med dopplinsen är att den har ett långt effektivt arbetsavstånd. Eftersom ett täckglas inte krävs, kan denna typ av lins närma sig provets yta, och som ett resultat begränsas upplösningen av de begränsningar som åläggs av sfärisk aberration snarare än de fysiska begränsningarna av täckglaset. Även om doppa linser kan vara mycket användbara, är de inte idealiska för alla experiment, eftersom handlingen att "doppa" linsen kan störa cellerna i provet. Dessutom, eftersom inkubationskammaren måste vara öppen mot linsen, måste förändringar i provmiljön på grund av avdunstning övervakas noggrant.
Fototoxicitet och fotoblekning
Idag är de flesta levande avbildningstekniker beroende av antingen högbelysningsregimer eller fluorescerande märkning, vilket både inducerar fototoxicitet och äventyrar förmågan att hålla cellerna oberörda och levande över tiden. Eftersom vår kunskap om biologi drivs av observation, är det nyckeln att minimera de störningar som induceras av bildtekniken.
Ökningen av konfokalmikroskopi är nära korrelerad med tillgängligheten för högeffektlasrar, som kan uppnå höga intensiteter av ljusexcitation. Den höga effektuteffekten kan dock skada känsliga fluoroforer , så lasrarna går vanligtvis betydligt under sin fulla effekt. Överexponering för ljus kan resultera i fotoskador på grund av fotoblekning eller fototoxicitet . Effekterna av fotoblekning kan avsevärt minska kvaliteten på fluorescerande bilder, och på senare år har det funnits en betydande efterfrågan på mer långvariga kommersiella fluoroforer. En lösning, Alexa Fluor -serien, visar liten eller ingen blekning även vid höga laserintensiteter.
Under fysiologiska förhållanden utsätts många celler och vävnadstyper för endast låga nivåer av ljus. Som ett resultat är det viktigt att minimera exponeringen av levande celler för höga doser av ultraviolett (UV), infrarött (IR) eller fluorescensspännande våglängder av ljus, vilket kan skada DNA , höja cellulära temperaturer och orsaka fotoblekning. Högenergifotoner som absorberas av fluoroforerna och provet emitteras vid längre våglängder proportionellt mot Stokes-skiftet . Däremot kan cellulära organeller skadas när fotonenergin producerar kemiska och molekylära förändringar snarare än att återutsändas. Man tror att den primära boven i den ljusinducerade toxiciteten som upplevs av levande celler är ett resultat av fria radikaler som produceras genom excitation av fluorescerande molekyler. Dessa fria radikaler är mycket reaktiva och orsakar förstörelse av cellulära komponenter, vilket kan resultera i icke-fysiologiskt beteende.
En metod för att minimera fotoskada är att sänka syrekoncentrationen i provet för att undvika bildning av reaktiva syreämnen . Denna metod är dock inte alltid möjlig vid avbildning av levande celler och kan kräva ytterligare ingrepp. En annan metod för att minska effekterna av fria radikaler i provet är användningen av antiblekningsreagens. Tyvärr kan de flesta kommersiella antiblekningsreagenser inte användas i levande cellavbildning på grund av deras toxicitet. Istället kan naturliga fria radikaler såsom vitamin C eller vitamin E användas utan att väsentligt förändra det fysiologiska beteendet på kortare tidsskalor. Fototoxicitetsfri levande cellavbildning har nyligen utvecklats och kommersialiserats. Holotomografisk mikroskopi undviker fototoxicitet tack vare sin lågeffektlaser (laserklass 1: 0,2 mW/mm 2 ).