Litet nukleolärt RNA
Inom molekylärbiologi är små nukleolära RNA ( snoRNAs ) en klass av små RNA- molekyler som i första hand vägleder kemiska modifieringar av andra RNA, främst ribosomala RNA , överförings-RNA och små nukleära RNA . Det finns två huvudklasser av snoRNA, C/D-box-snoRNA, som är associerade med metylering , och H/ACA-box-snoRNA, som är associerade med pseudouridylering . SnoRNA kallas vanligtvis guide-RNA men bör inte förväxlas med guide-RNA som styr RNA-redigering i trypanosomer .
snoRNA guidade modifieringar
Efter transkription genomgår begynnande rRNA- molekyler (kallade pre-rRNA) en serie bearbetningssteg för att generera den mogna rRNA-molekylen. Före klyvning av exo- och endonukleaser genomgår pre-rRNA:t ett komplext mönster av nukleosidmodifieringar. Dessa inkluderar metyleringar och pseudouridyleringar, styrda av snoRNA.
- Metylering är bindning eller substitution av en metylgrupp på olika substrat . Människans rRNA innehåller cirka 115 metylgruppsmodifikationer. Majoriteten av dessa är 2'O-ribos-metyleringar (där metylgruppen är bunden till ribosgruppen).
- Pseudouridylering är omvandlingen ( isomerisering ) av nukleosiden uridin till en annan isomer form av pseudouridin (Ψ). Denna modifiering består av en 180º rotation av uridinbasen runt dess glykosylbindning till ribosen i RNA-ryggraden. Efter denna rotation bidrar kvävebasen med en kolatom till glykosylbindningen istället för den vanliga kväveatomen. Den fördelaktiga aspekten av denna modifiering är den ytterligare vätebindningsdonatorn som finns tillgänglig på basen. Medan uridin gör två vätebindningar med sitt Watson-Crick baspar, kan adenin, pseudouridin göra tre vätebindningar. När pseudouridin är basparat med adenin kan det också skapa en annan vätebindning, vilket gör att komplexiteten hos den mogna rRNA-strukturen kan ta form. Den fria vätebindningsdonatorn bildar ofta en bindning med en bas som är avlägsen från sig själv, vilket skapar den tertiära strukturen som rRNA måste ha för att vara funktionell. Mogna humana rRNA innehåller cirka 95 Ψ modifieringar.
Varje snoRNA-molekyl fungerar som en guide för endast en (eller två) individuella modifieringar i ett mål-RNA. För att utföra modifiering associerar varje snoRNA med minst fyra kärnproteiner i ett RNA/proteinkomplex som kallas en liten nukleolär ribonukleoproteinpartikel (snoRNP). Proteinerna associerade med varje RNA beror på typen av snoRNA-molekyl (se snoRNA-guidefamiljer nedan). SnoRNA-molekylen innehåller ett antisenselement (en sträcka på 10–20 nukleotider ), som är baskomplementära till sekvensen som omger basen ( nukleotid ) som är mål för modifiering i pre-RNA-molekylen. Detta gör det möjligt för snoRNP att känna igen och binda till mål-RNA:t. När snoRNP har bundit till målstället, är de associerade proteinerna på rätt fysisk plats för att katalysera den kemiska modifieringen av målbasen.
snoRNA vägleder familjer
De två olika typerna av rRNA-modifiering (metylering och pseudouridylering) styrs av två olika familjer av snoRNA. Dessa familjer av snoRNA kallas antisens C/D-box och H/ACA box snoRNA baserat på närvaron av konserverade sekvensmotiv i snoRNA. Det finns undantag, men som en allmän regel styr C/D-boxmedlemmar metylering och H/ACA-medlemmar styr pseudouridylering. Medlemmarna i varje familj kan variera i biogenes, struktur och funktion, men varje familj klassificeras av följande generaliserade egenskaper. För mer information, se recension. SnoRNA klassificeras under litet nukleärt RNA i MeSH . HGNC i samarbete med snoRNABase och experter inom området godkänt unika namn för mänskliga gener som kodar för snoRNA .
C/D box
C/D-box-snoRNA innehåller två korta konserverade sekvensmotiv, C (RUGAUGA) och D (CUGA), belägna nära 5′- respektive 3′ -ändarna av snoRNA. Korta regioner (~ 5 nukleotider) belägna uppströms om C-boxen och nedströms om D-boxen är vanligtvis baskomplementära och bildar en stam-box-struktur, vilket bringar C- och D-box-motiven nära varandra. Denna stam-box-struktur har visat sig vara väsentlig för korrekt snoRNA-syntes och nukleolär lokalisering. Många C/D-box-snoRNA innehåller också en ytterligare mindre välkonserverad kopia av C- och D-motiven (refererade till som C' och D') belägna i den centrala delen av snoRNA-molekylen. En konserverad region på 10–21 nukleotider uppströms om D-boxen är komplementär till metyleringsstället för mål-RNA:t och gör det möjligt för snoRNA:t att bilda en RNA-duplex med RNA:t. Nukleotiden som ska modifieras i mål-RNA:t är vanligtvis belägen vid den 5:e positionen uppströms från D-boxen (eller D'-boxen). C/D box snoRNA associeras med fyra evolutionärt konserverade och essentiella proteiner - fibrillarin (Nop1p), NOP56 , NOP58 och SNU13 (15,5 kD protein i eukaryoter; dess arkeala homolog är L7Ae) - som utgör kärnan C/D box snoRNP .
Det finns ett eukaryot C/D-box-snoRNA ( snoRNA U3 ) som inte har visats vägleda 2'- O -metylering. Istället fungerar det i rRNA-bearbetning genom att styra pre-rRNA-klyvning.
H/ACA box
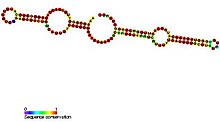
H/ACA box snoRNAs har en gemensam sekundär struktur som består av två hårnålar och två enkelsträngade regioner som kallas en hårnål-gångjärn-hårnål-svansstruktur. H/ACA snoRNA innehåller också konserverade sekvensmotiv kända som H box (konsensus ANANNA) och ACA box (ACA). Båda motiven är vanligtvis belägna i de enkelsträngade områdena i den sekundära strukturen. H-motivet är beläget i gångjärnet och ACA-motivet är beläget i svansregionen; 3 nukleotider från 3′-änden av sekvensen. Hårnålsregionerna innehåller inre utbuktningar kända som igenkänningsslingor i vilka antisens-guidesekvenserna (baser som är komplementära till målsekvensen) är belägna. Dessa guidesekvenser markerar i huvudsak platsen för uridinet på mål-rRNA:t som kommer att modifieras. Denna igenkänningssekvens är tvådelad (konstruerad från de två olika armarna av slingregionen) och bildar komplexa pseudo-knutar med mål-RNA:t. H/ACA box snoRNAs associerar med fyra evolutionärt konserverade och essentiella proteiner - dyskerin (Cbf5p), GAR1 , NHP2 och NOP10 - som utgör kärnan i H/ACA box snoRNP. Dyskerin är sannolikt den katalytiska komponenten i ribonukleoproteinkomplexet (RNP) eftersom det har flera konserverade pseudouridinsyntassekvenser och är nära besläktat med pseudouridinsyntaset som modifierar uridin i tRNA . I lägre eukaryota celler såsom trypanosomer, finns liknande RNA i form av enkel hårnålsstruktur och en AGA-box istället för ACA-box vid 3′-änden av RNA. Liksom trypanosomer Entamoeba histolytica en blandad population av enkel hårnål såväl som dubbel hårnål H/ACA box snoRNA. Det rapporterades att det inträffade bearbetning av det dubbla hårnåls-H/ACA-box-snoRNA till enkel-hårnåls-snoRNA, men till skillnad från trypanosomer har det ett vanligt ACA-motiv vid 3′ svans. [19]
RNA-komponenten av humant telomeras (hTERC) innehåller en H/ACA-domän för pre-RNP-bildning och nukleolär lokalisering av själva telomeras-RNP. H/ACA snoRNP har varit inblandad i den sällsynta genetiska sjukdomen dyseratosis congenita (DKC) på grund av dess koppling till humant telomeras. Mutationer i proteinkomponenten i H/ACA snoRNP resulterar i en minskning av fysiologiska TERC-nivåer. Detta har starkt korrelerats med patologin bakom DKC, som främst verkar vara en sjukdom med dålig telomerunderhåll .
Komposit H/ACA och C/D box
En ovanlig guide snoRNA U85 som fungerar i både 2'-O-ribosmetylering och pseudouridylering av små nukleärt RNA (snRNA) U5 har identifierats. Detta sammansatta snoRNA innehåller både C/D- och H/ACA-boxdomäner och associerar med de proteiner som är specifika för varje klass av snoRNA (fibrillarin respektive Gar1p). Fler sammansatta snoRNA har nu karakteriserats.
Dessa sammansatta snoRNA har visat sig ackumuleras i en subnukleär organell som kallas Cajal-kroppen och kallas små Cajal-kroppsspecifika RNA (scaRNA). Detta är i motsats till majoriteten av C/D-box- eller H/ACA-box-snoRNA, som lokaliseras till nukleolen. Dessa Cajal-kroppsspecifika RNA föreslås vara involverade i modifieringen av RNA-polymeras II-transkriberade spliceosomala RNA U1, U2, U4, U5 och U12. Inte alla snoRNA som har lokaliserats till Cajal-kroppar är sammansatta C/D och H/ACA box snoRNA.
Föräldralösa snoRNA
Målen för nyligen identifierade snoRNA förutsägs på basis av sekvenskomplementaritet mellan förmodade mål-RNA och antisenselementen eller igenkänningsslingorna i snoRNA-sekvensen. Det finns dock ett ökande antal "föräldralösa" guider utan några kända RNA-mål, vilket tyder på att det kan finnas fler proteiner eller transkript inblandade i rRNA än tidigare och/eller att vissa snoRNA har andra funktioner som inte gäller rRNA. Det finns bevis för att några av dessa föräldralösa snoRNA reglerar alternativt splitsade transkript. Till exempel verkar det som att C/D-boxen snoRNA SNORD115 reglerar den alternativa splitsningen av serotonin 2C-receptorn mRNA via en konserverad region av komplementaritet. En annan C/D-box snoRNA, SNORD116 , som finns i samma kluster som SNORD115 har förutspåtts ha 23 möjliga mål inom proteinkodande gener med hjälp av en bioinformatisk metod. Av dessa visade sig en stor del vara alternativt skarvning, vilket tyder på en roll för SNORD116 i regleringen av alternativ skarvning.
Måländringar
Den exakta effekten av metylerings- och pseudouridyleringsmodifikationerna på funktionen hos de mogna RNA:erna är ännu inte känd. Modifikationerna verkar inte vara väsentliga men är kända för att subtilt förbättra RNA-veckningen och interaktionen med ribosomala proteiner. Som stöd för deras betydelse är målställemodifieringar uteslutande lokaliserade inom konserverade och funktionellt viktiga domäner av det mogna RNA:t och är vanligtvis konserverade bland avlägsna eukaryoter. En ny metod, Nm-REP-seq, utvecklades för att berika 2'-O-metyleringar styrda av C/D snoRNA genom att använda RNA-exoribonukleas (Mycoplasma genitalium RNase R, MgR) och perjodatoxidationsreaktivitet för att eliminera 2'-hydroxylerad (2) '-OH) nukleosider.
- 2'-O-metylerad ribos orsakar en ökning av 3'-endokonformationen
- Pseudouridin (psi/Ψ) lägger till ytterligare ett alternativ för H-bindning.
- Kraftigt metylerat RNA är skyddat från hydrolys. rRNA fungerar som ett ribozym genom att katalysera sin egen hydrolys och splitsning.
Genomisk organisation
SnoRNA finns på olika sätt i genomet. Majoriteten av snoRNA-gener från ryggradsdjur kodas i intronerna av gener som kodar för proteiner involverade i ribosomsyntes eller translation, och syntetiseras av RNA-polymeras II . SnoRNA har också visat sig vara lokaliserade i intergena regioner, ORF av proteinkodande gener och UTR. SnoRNA kan också transkriberas från sina egna promotorer av RNA-polymeras II eller III .
Stämplade loci
I det mänskliga genomet finns det åtminstone två exempel där C/D-box-snoRNA:n finns i tandemupprepningar inom präglade loci. Dessa två loci (14q32 på kromosom 14 och 15q11q13 på kromosom 15) har karakteriserats i stor utsträckning, och i båda regionerna har flera snoRNA hittats lokaliserade inom introner i kluster av närbesläktade kopior.
I 15q11q13 har fem olika snoRNA identifierats ( SNORD64 , SNORD107, SNORD108, SNORD109 (två exemplar), SNORD116 (29 exemplar) och SNORD115 (48 exemplar). Förlust av de 29 exemplaren av SNORD1-185 av SBORD1-185-regionen identifierats som en orsak till Prader-Willis syndrom medan vinst av ytterligare kopior av SNORD115 har kopplats till autism .
Region 14q32 innehåller upprepningar av två snoRNA SNORD113 (9 kopior) och SNORD114 (31 kopior) inom intronerna av ett vävnadsspecifikt ncRNA-transkript ( MEG8 ). 14q32-domänen har visat sig dela gemensamma genomiska egenskaper med de präglade 15q11-q13 loci och en möjlig roll för tandemupprepningar av C/D-box snoRNAs i utvecklingen eller mekanismen för präglade loci har föreslagits.
Andra funktioner
snoRNA kan fungera som miRNA . Det har visat sig att humant ACA45 är ett bona fide snoRNA som kan bearbetas till ett 21- nukleotider långt moget miRNA av RNAse III-familjen endoribonukleas dicer . Denna snoRNA-produkt har tidigare identifierats som mmu-miR-1839 och har visat sig bearbetas oberoende av det andra miRNA-genererande endoribonukleaset drosha . Bioinformatiska analyser har avslöjat att förmodat snoRNA-härledda, miRNA-liknande fragment förekommer i olika organismer.
Nyligen har det visat sig att snoRNA kan ha funktioner som inte är relaterade till rRNA. En sådan funktion är regleringen av alternativ splitsning av transgentranskriptet , vilket görs av snoRNA HBII-52 , som också är känt som SNORD115.
I november 2012, Schubert et al. avslöjade att specifika RNA kontrollerar kromatinkomprimering och tillgänglighet i Drosophila -celler.
externa länkar
- human snoRNA-atlas från små RNA-sekvenseringsdata
- växt snoRNA-databas
- snoRNAbas: human H/ACA och C/D box snoRNA databas
- snoRNP-databas
- Jäst snoRNA-databasen
- mänskligt snoRNA uttrycksmönster
- Rfam-sida för C/D-box snoRNA
- Rfam sida för H/ACA box snoRNAs
- Rfam-sida för scaRNA snoRNA
