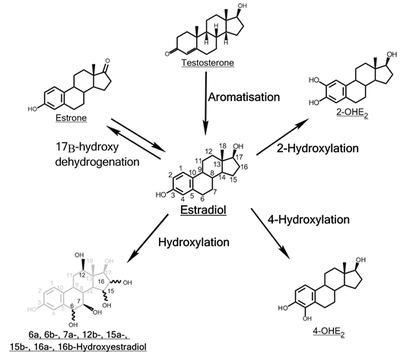
Hydroxylering av östradiol
Hydroxyleringen av östradiol är en av de viktigaste metabolismvägarna för östrogensteroidhormonet estradiol . Det hydroxyleras till katekolöstrogenerna 2-hydroxiestradiol och 4-hydroxiestradiol och till östriol (16α-hydroxiestradiol), reaktioner som katalyseras av cytokrom P450- enzymer främst i levern , men även i olika andra vävnader .
2-Hydroxylering
Tillägg av en hydroxylgrupp vid C2 representerar den huvudsakliga levervägen för östradiolmetabolism, som medierad av CYP1A2 , CYP2C8 , CYP2C9 och CYP3A4 . Extrahepatisk 2-hydroxylering medieras huvudsakligen av CYP1A1 och CYP3A4 .
2-hydroxiestradiol (2-OHE 2 ) kan drabbas av tre metaboliska öden: metylering för att ge 2-meOHE 2 , oxidation för att bilda kinoner , eller dehydrering för att ge 2-OHE 1 .
2-OHE 2 kan binda till östrogenreceptorer men med markant lägre affinitet. Denna metabolit har flera fysiologiska konsekvenser: förmågan att påverka intracellulär signalering, adenohypofyshormonutsöndring, radikal- och kinonbildning och hämning av tumörbildning. Svag cancerframkallande aktivitet har visats, troligen på grund av radikalbildning och induktion av enkelsträngade DNA-brott.
Inaktivering av 2-OHE2 katalyseras av katekol-O-metyltransferas (COMT), där COMT uppvisar en snabbare hastighet för metylering av 2-OHE2 jämfört med 4-OH- E2 . COMT, ett blodburet enzym, förmedlar den vanligaste formen av 2- eller 4-hydroxiestradiolinaktivering, förutom glukuronidering och sulfatering. Denna inaktivering kan dock möjliggöra ackumulering av 4-OHE2 , eftersom 2-OHE2 hämmar 4-OHE2 - metylering av COMT, men 4-OHE2 hämmar inte 2-OH-E2- metylering i gengäld.
Antitumöraktivitet av 2-meOE 2 tros förmedlas av antiproliferativa och antimetastatiska effekter. Hämning av cellulär proliferation och metastaser verkar ske via induktion av kaspas-8 , följt av kaspas-3 och slutligen DNA-fragmentering. Induktion av apoptos av 2-meOE2 kan vara p53- beroende eller oberoende. 2-meOE2 har också visat sig hämma aromatasaktivitet och därigenom sänka in situ-syntesen av E2 i cancervävnad. 2-meOE 2 har en högre bindningsaffinitet för könshormonbindande globulin (SHBG) än E 2 och 2-OH-E 2 och har ingen affinitet för östrogenreceptorn.
2-meOE2 är också en potent hämmare av angiogenes i tumörvävnader. Administrering av denna östradiolmetabolit förhindrar vaskulär glattmuskeltillväxt. Denna hämning av angiogenes elimineras genom samtidig administrering med cytokrom P450 och COMT-hämmare, vilket bekräftar involveringen av cytokrom P450-enzymer i blockaden av tumörblodtillförseln.
Ytterligare antitumöraktivitet av 2-meOE 2 har identifierats genom immunmodulering. Cytokinerna IL-6 och TNFa , såväl som prostaglandin PGE2 , har förmåga att stimulera aromatasaktivitet. Eftersom makrofager och lymfocyter är närvarande i bröstvävnad, tillhandahåller detta ett bekymmersamt sätt att uppreglera in situ östradiolbiosyntes. 2-meOE 2 verkade kunna halvera den basala aromatasaktiviteten i bröstfibroblaster , möjligen genom destabilisering av mikrotubulierna som förmedlar translokation av cytokinreceptorerna till plasmamembranet. Hämning av cytokinreceptorsyntes och blockad av de autokrina och parakrina verkningarna av cytokiner och PGE2 observerades också.
4-Hydroxylering

Det enzym som är mest ansvarigt för östradiol-4-hydroxylering är CYP1B1 . Hos människor uppvisar CYP1B1-mRNA och protein konstitutivt uttryck i lunga och njure, såväl som östrogenreglerade vävnader såsom bröst, äggstockar och livmoder. Medan 4-hydroxylering utgör den mindre vägen i levern, ändrar den större andelen CYP1B1-uttryck i extrahepatiska vävnader balansen till förmån för 4-OH-E2- bildning . 4-OH-E 2 tros vara den mest cancerframkallande av alla östradiolmetaboliter, särskilt med tanke på att CYP1B1 uppvisar överuttryck i bröstcancertumörer.
4-OH-E2 , liksom 2-OH-E2 , kan vara fysiologiskt aktiva såväl som tumörframkallande. 4-OH-E2 kan binda ER med en reducerad dissociationshastighet och förlängd aktivering, vilket inducerar celltillväxt och proliferation, adenohypofyshormonutsöndring och prostaglandinproduktion.
Das et al. implicerade 4-OH-E 2 i induktionen av östrogenkänsliga gener, ett svar som uppvisade partiell eller ingen upphävande genom samtidig administrering med ett antiöstrogen, vilket ger bevis för förmågan hos 4-OH-E 2 att utföra genetisk uppreglering via en väg oberoende av ER-signalering. Effekter oberoende av ER-bindning inkluderar brott av enkelsträngat DNA, särskilt när det interagerar synergistiskt med kväveoxid i mänskliga bröstcancerceller och produktion av kinoner och fria radikaler.
CYP1B1 kan induceras av E2 . ERα, efter bindning till östradiol, interagerar med CYP1B1 ERE för att stimulera CYP1B1-uttryck. Sålunda, även om E2 orsakar genetiska förändringar som bidrar till dess egen inaktivering, ger minskningen av östrogen aktivitet en toxikologiskt aktiv metabolit som utgör en ytterligare väg för östradiolberoende karcinogenes .
4-OH-E2 delar det metaboliska schemat för 2-OH-E2 : metylering till 4-metoxiestradiol (4-meOE2 ) , oxidation till kinoner eller dehydrering till 4-OH- E1 . Konjugering av den allestädes närvarande COMT representerar den vanligaste extrahepatiska vägen för 4-OH-E2- inaktivering . Men om östrogenhomeostas är obalanserad av en ökning av CYP1B1 och en minskning av COMT, kommer en högre grad av genotoxisk kinonbildning från 4-OH-E 2 att inträffa. 4-OHE 2 kan oxideras av mikrosomala CYP eller peroxidaser för att ge östradiol-3,4-semikinon. Denna semikinon kan genomgå redoxcykling med syre för att bilda östradiol-3,4-kinon (E 2 -3,4-Q) och superoxid. E2-3,4 -Q kan omvandlas tillbaka till 4-OHE2 i ett enda steg med kinonreduktas, eller i två sekventiella steg katalyserat av P450- reduktas via semikinonintermediären. GSH/S-transferasaktivitet kan upphäva E2-3,4 - Q-nivåer via bildning av glutationkonjugat.
E2-3,4 -Q är en potent nukleofil och reagerar lätt med elektrofilt DNA . Detta ger bildandet av DNA-addukterna 4-OHE2-1 - N7Gua och 4-OHE2-1 - N3Ade via en Michael-addition . Destabilisering av glykosylbindningen mellan den kvävehaltiga basen och ribossockret skapar apuriniska ställen eftersom de instabila addukterna går förlorade från DNA. 4-OHE 2 -1-N7Gua har en relativt långsam depurineringshalveringstid på ca. 3 timmar, vilket ger tillräckligt med tid för reparationsmekanismer för basexcision att korrigera förändringen. Emellertid uppvisar 4-OHE2-1 - N3Ade omedelbar depurinering, vilket leder till felbenägen reparation och induktion av mutationer. Faktum är att E2-3,4 - Q har visat sig orsaka A-till-G-mutationer i genen som kodar för H¬-ras, eftersom ras är avgörande för korrekt reglering av det cellulära svaret på tillväxtfaktorer. Även om 2- och 4-OHE 2 har liknande redoxpotentialer och därmed liknande redoxcykelaktivitet, kan den större cancerogena kapaciteten hos 4-OHE 2 tillskrivas dess ökade reaktivitet med DNA. En annan skadlig effekt av östrogenredoxcykling är produktionen av superoxid- och hydroxylradikaler. P450-reduktaskatalys producerar superoxidradikaler, som i närvaro av superoxiddismutas och Fe 3+ kan bilda mycket reaktiva hydroxylradikaler som kan skada praktiskt taget alla makromolekyler.
16a-Hydroxylering
Genom verkan av CYP1A1 , CYP1A2 , CYP2C8 och CYP3A isoformerna produceras 16α-hydroxiestradiol (16α-OHE 2 ), även känd som östriol, i överflöd under graviditeten. 16a-OHE 2 kan dehydreras till 16a-hydroxiöstron (16a-OHE 1 ), en metabolit som har visat sig binda kovalent till östrogenreceptorn via Schiff-basbildning. Denna kovalenta koppling sker mellan steroiden karbonyl och e-aminogruppen i lysin. I teorin kan 16a-OHE 1 också binda DNA, även om detta inte har observerats. 16a-OHE 2 är en potent ER-agonist, kapabel till nivåer av cellulär proliferationsstimulering som är nära de som erhålls med E 2 . Även om studier i hamsternjurtumörmodeller visade svag karcinogenicitet, är den karcinogena potentialen för 16α-OHE 2 hos människor fortfarande okänd.
Andra hydroxyleringar
Funktionen för resten av de hydroxylerade E 2 -metaboliterna (6α-, 6β-, 7α-, 12β-, 15α-, 15β- och 16β-OHE 2 ) återstår att belysa. Vissa av dessa metaboliter, såsom 15α-OHE 2 , utsöndras i relativt stora mängder hos gravida kvinnor, vilket möjligen fungerar som en indikator på god fosterhälsa .