Hexafluorfosfat
|
|
|||
| Namn | |||
|---|---|---|---|
|
IUPAC namn
Hexafluorfosfat
|
|||
|
Systematiskt IUPAC-namn
Hexafluoro-λ 5 -fosfanuid (substitutiv) Hexafluoridofosfat(1-) (tillsats) |
|||
| Andra namn Hexafluorfosfat(V)
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL |
|
||
| ChemSpider | |||
| ECHA InfoCard | 100.111.656 | ||
| EG-nummer |
|
||
| 2704 | |||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| [PF 6 ] − | |||
| Molar massa | 144,964181 g/mol | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
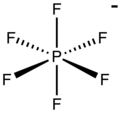
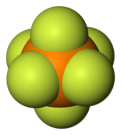
Hexafluorfosfat är en anjon med den kemiska formeln [PF 6 ] − . Det är en oktaedrisk art som inte ger någon färg till dess salter. [PF 6 ] − är isoelektronisk med svavelhexafluorid , SF 6 , och hexafluorosilikatdianjonen , [SiF 6 ] 2− , och hexafluorantimonat [SbF 6 ] − . I denna anjon fosfor en valens på 5. Eftersom hexafluorfosfat är dåligt nukleofilt klassificeras hexafluorfosfat som en icke-koordinerande anjon .
Syntes
Hexafluorfosfatsalter kan framställas genom reaktion av fosforpentaklorid och alkali- eller ammoniumhalogenid i en lösning av fluorvätesyra :
- PCl5 + MCl + 6 HF → M[PF6] + 6 HCl
Hexafluorfosforsyra kan framställas genom direkt reaktion mellan vätefluorid och fosforpentafluorid . Det är en stark Brønsted-syra som vanligtvis genereras in situ omedelbart före användning.
- PF 5 + HF → H[PF 6 ]
Dessa reaktioner kräver specialiserad utrustning för att säkert hantera de faror som är förknippade med fluorvätesyra och vätefluorid.
Kvantitativ analys
Flera metoder för kvantitativ analys för hexafluorfosfatjonen har utvecklats. Tetrafenylarsoniumklorid, . [(C6H5 ) 4As ] Cl , har använts både för titrimetriska och gravimetriska kvantifieringar av hexafluorfosfat Båda dessa bestämningar beror på bildandet av tetrafenylarsoniumhexafluorfosfat:
- [ ( C6H5 ) 4As ] ++ [ PF6 ] - → [ ( C6H5 ) 4As ] [ PF6 ]
Hexafluorfosfat kan också bestämmas spektrofotometriskt med ferroin .
Reaktioner
Hydrolysen är extremt långsam under grundläggande förhållanden. Syrakatalyserad hydrolys till fosfatjonen är också långsam. Icke desto mindre är hexafluorfosfat benäget att sönderfalla med frisättning av vätefluorid i joniska vätskor .
Organometallisk och oorganisk syntes
Hexafluorfosfat är en vanlig motanjon för katjoniska metallkomplex . Det är en av tre allmänt använda icke-koordinerande anjoner: hexafluorfosfat, tetrafluoroborat [BF 4 ] − och perklorat ClO − 4 . Av dessa har hexafluorfosfatjonen den minsta koordinerande tendensen.
Hexafluorfosfatsalter kan framställas genom reaktioner av silverhexafluorfosfat med halogenidsalter. Utfällning av olöslig silverhalogenid hjälper till att driva denna reaktion till fullbordan. Eftersom hexafluorfosfatsalter ofta är olösliga i vatten men lösliga i polära organiska lösningsmedel, ger även tillsatsen av ammoniumhexafluorfosfat ( [NH 4 ][PF 6 ] ) till vattenlösningar av många organiska och oorganiska salter fasta fällningar av hexafluorfosfatsalter. Ett exempel är syntesen av rhodoceniumsalter : Den övergripande omvandlingsekvationen är
- RhCl3 · n H2O + 2 C5H6 + [NH4 ] [ PF6 ] → [( η5 - C5H5 ) 2Rh ] [ PF6 ] + 2 HCl + [ NH4 ] Cl + n H2O _ _
Tetrakis(acetonitril)koppar(I)hexafluorfosfat framställs genom tillsats av hexafluorfosforsyra till en suspension av koppar(I)oxid i acetonitril:
- Cu2O + 2 H[PF6 ] + 8 CH3CN → 2 [Cu( CH3CN ) 4 ] [ PF6 ] + H2O
Hydrolys av hexafluorfosfatkomplex
Även om hexafluorfosfatjonen i allmänhet är inert och därmed en lämplig motjon , kan dess solvolys induceras av starkt elektrofila metallcentra. Till exempel genomgår tris( solvento ) rhodiumkomplexet [( η 5 -C 5 Me 5 )Rh(Me 2 CO) 3 ][PF ] 2 solvolys 6 när det upphettas i aceton , vilket bildar ett difluorfosfatöverbryggat komplex [( η 5 -C5Me5 ) Rh ( μ - OPF2O ) 3Rh ( η5 - C5Me5 ) ] [ PF6 ] . _ _
Ansökningar
Praktisk användning av hexafluorfosfatjonen utnyttjar typiskt en eller flera av följande egenskaper: att det är en icke-koordinerande anjon ; att hexafluorfosfatföreningar vanligtvis är lösliga i organiska lösningsmedel, särskilt polära sådana, men har låg löslighet i vattenlösning ; eller att den har en hög grad av stabilitet, inklusive motståndskraft mot både sur och basisk hydrolys .
Sekundära batterier
Den huvudsakliga kommersiella användningen av hexafluorfosfat är som dess litiumsalt, litiumhexafluorfosfat . Detta salt, i kombination med dimetylkarbonat , är en vanlig elektrolyt i kommersiella sekundära batterier som litiumjonceller . Denna applikation utnyttjar den höga lösligheten av hexafluorfosfatsalter i organiska lösningsmedel och motståndet hos dessa salter mot reduktion av alkalimetallkatoden. Eftersom litiumjonerna i dessa batterier i allmänhet är närvarande som koordinationskomplex i elektrolyten, är den icke-koordinerande naturen hos hexafluorfosfatjonen också en användbar egenskap för dessa tillämpningar.
Joniska vätskor
Rumstempererade joniska vätskor såsom 1-butyl-3-metylimidazoliumhexafluorfosfat (typiskt förkortat som bmimPF6) har framställts. Fördelen med anjonbytet till förmån för en icke-koordinerande anjon är att den resulterande joniska vätskan har mycket större termisk stabilitet. 1-Butyl-3-metylimidazoliumklorid sönderdelas till N -metylimidazol och 1-klorbutan eller till N -butylimidazol och klormetan . Sådana sönderdelningar är inte möjliga för bmimPF 6 . Emellertid är termiska sönderdelningar av hexafluorfosfatjoniska vätskor för att generera vätefluoridgas kända.