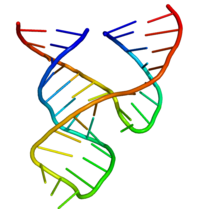
Hammerhead ribozym
Hammarhead- ribozymet är ett RNA- motiv som katalyserar reversibla klyvnings- och ligeringsreaktioner på ett specifikt ställe i en RNA-molekyl. Det är en av flera katalytiska RNA ( ribozymer ) som är kända för att förekomma i naturen. Det fungerar som ett modellsystem för forskning om strukturen och egenskaperna hos RNA, och används för målinriktade RNA-klyvningsexperiment, några med föreslagna terapeutiska tillämpningar. Uppkallad efter likheten mellan tidiga sekundära strukturdiagram med en hammarhaj , upptäcktes hammarhuvudsribozymer ursprungligen i två klasser av växtvirusliknande RNA: satellit-RNA och viroider . De är också kända i vissa klasser av retrotransposoner , inklusive retrozymer . Hammarhead-ribozym-motivet har rapporterats överallt i linjer över livets träd.
Självklyvningsreaktionerna, som först rapporterades 1986, är en del av en rullande cirkelreplikationsmekanism . Hammarhuvudsekvensen är tillräcklig för självklyvning och verkar genom att bilda en konserverad tredimensionell tertiär struktur.
Katalys
I sitt naturliga tillstånd är ett hammarhuvud-RNA-motiv en enkelsträng av RNA. Även om klyvningen sker i frånvaro av proteinenzymer , är hammarhuvudets RNA i sig inte en katalysator i sitt naturliga tillstånd, eftersom det förbrukas av reaktionen (dvs. utför självklyvning) och därför inte kan katalysera flera omsättningar.
Transagerande hammarhuvudkonstruktioner kan konstrueras så att de består av två interagerande RNA-strängar, där en sträng utgör ett hammarhuvud-ribozym som klyver den andra strängen. [ citat behövs ] Den sträng som spjälkas kan tillföras i överskott och multipel omsättning kan påvisas och visa sig lyda Michaelis-Menten kinetik , [ hänvisning behövs ] typisk för proteinenzymkinetik . Sådana konstruktioner används vanligtvis för in vitro -experiment, och termen "hammerhead-RNA" har i praktiken blivit synonymt med det mer frekvent använda "hammerhead- ribozym ".
Den minimala transverkande hammarhuvud-ribozymsekvensen som är katalytiskt aktiv består av tre basparade stammar som flankerar en central kärna av 15 konserverade (mestadels invarianta) nukleotider , som visas. De konserverade centrala baserna, med få undantag, är väsentliga för ribozyms katalytiska aktivitet. Sådana hammarhuvudsribozymkonstruktioner uppvisar in vitro en omsättningshastighet ( kcat Km ) av cirka 1 molekyl/minut och en i . storleksordningen 10 nanomolar
Hammarhead-ribozymet är utan tvekan det bäst karakteriserade ribozymet. Dess ringa storlek, grundligt undersökta klyvningskemi, kända kristallstruktur och dess biologiska relevans gör hammarhuvudsribozymet särskilt väl lämpat för biokemiska och biofysikaliska undersökningar av RNA-katalysens grundläggande natur.
Hammerhead-ribozymer kan spela en viktig roll som terapeutiska medel; som enzymer som skräddarsyr definierade RNA-sekvenser, som biosensorer och för tillämpningar inom funktionell genomik och genupptäckt.
Artfördelning
| Hammerhead ribozym HH9 | |
|---|---|
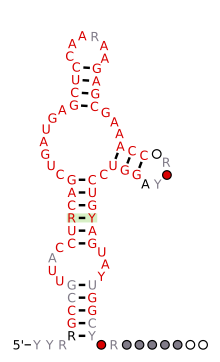 Förutspådd sekundär struktur och sekvenskonservering av HH9 ribozym hittat konserverat från ödla till mänskliga genom
| |
| Identifierare | |
| Symbol | HH9 |
| Rfam | RF02275 |
| Övriga uppgifter | |
| RNA -typ | Gen ; ribozym |
| Domän(er) | Eukaryota |
| SÅ | SO:0000380 |
| PDB- strukturer | PDBe |
1986 hittades de första hammarhuvud-ribozymen i RNA-växtpatogener som viroider och virala satelliter. Ett år senare rapporterades också ett hammarhuvudsribozym i satellit-DNA från vattensalamandergenom. Nya exempel på detta ribozym hittades sedan i arvsmassan hos obesläktade organismer som schistosomer, grottsyrsor, Arabidopsis thaliana och några få däggdjur som gnagare och platypus. År 2010 fann man att hammarhuvudsribozymet förekommer i en mängd olika bakteriella och eukaryala genom, och även hos människor. Liknande rapporter bekräftade och utökade dessa observationer, och avslöjade hammarhuvudsribozymet som ett allestädes närvarande katalytiskt RNA i alla livets riken.
De flesta eukaryota hammarhuvudribozymer är relaterade till ett slags korta interspersed retroelements (SINEs) som kallas retrozymes , som uttrycks som små cirkulära RNA. Emellertid kan en exceptionell grupp av slående konserverade hammarhuvuden hittas i genomen hos alla amnioter . Dessa hammarhuvud-ribozymer (de så kallade HH9 och HH10) förekommer i intronerna av ett fåtal specifika gener och pekar på en bevarad biologisk roll under pre-mRNA-biosyntes. År 2021 befanns nya hepatit_D- virusgenom av cirkulärt RNA från olika djur koda för hammarhuvudsribozymer som liknar de som finns i växtviroider och virala satelliter. En massiv bioinformatisk sökning av deltavirusliknande medel runt om i världen har avslöjat hundratals exempel på cirkulära RNA-genom som bär hammarhuvudmotiv, vilket indikerar att inte bara detta ribozym utan små cirkulära RNA med ribozymer är allestädes närvarande molekyler i biosfären.
Katalysens kemi
Hammarhuvudsribozymet utför en mycket enkel kemisk reaktion som resulterar i att substratsträngen av RNA bryts av, specifikt vid C17, nukleotiden för klyvningsstället. Även om RNA-klyvning ofta kallas hydrolys , involverar den använda mekanismen faktiskt inte tillsats av vatten . Snarare är klyvningsreaktionen helt enkelt en isomerisering som består av omarrangemang av den länkande fosfodiesterbindningen . Det är samma reaktion, kemiskt, som sker med slumpmässig basmedierad RNA-nedbrytning, förutom att den är mycket platsspecifik och hastigheten accelereras 10 000 gånger eller mer.
Klyvning genom fosfodiesterisomerisering

Klyvningsreaktionen är en fosfodiester - isomeriseringsreaktion som initieras genom abstraktion av klyvningsstället ribos 2'-hydroxyl proton från 2'-syren, som sedan blir den attackerande nukleofilen i en "in-line" eller S N 2(P) ) -liknande reaktion, även om det inte är känt om denna proton avlägsnas före eller under det kemiska steget av hammarhuvudklyvningsreaktionen. (Klyvningsreaktionen är tekniskt sett inte bimolekylär , utan beter sig på samma sätt som en äkta SN 2 (P)-reaktion gör; den genomgår inversion av konfigurationen efter att det bildar ett associativt övergångstillstånd bestående av en pentakoordinerad oxifosfran.) Den attackerande och lämnande gruppsyrer kommer båda att uppta de två axiella positionerna i den trigonala bipyramidala övergångstillståndsstrukturen som krävs för en SN 2 -liknande reaktionsmekanism.
5'-produkten, som ett resultat av denna klyvningsreaktionsmekanism, har en 2',3'-cyklisk fosfatände, och 3'-produkten har en 5'-OH-ände, som med icke-enzymatisk alkalisk klyvning av RNA. Reaktionen är därför reversibel, eftersom det sprickbara fosfatet förblir en fosfodiester, och kan således fungera som ett substrat för hammarhuvud-RNA-medierad ligering utan krav på ATP eller en liknande exogen energikälla. Den hammarhuvud-ribozymkatalyserade reaktionen, till skillnad från den formellt identiska icke-enzymatiska alkaliska klyvningen av RNA, är en mycket sekvensspecifik klyvningsreaktion med en typisk omsättningshastighet på cirka 1 molekyl substrat per molekyl enzym per minut vid pH 7,5 i 10 mM Mg 2+ (så kallade "standardreaktionsbetingelser" för den minimala hammarhuvud-RNA-sekvensen), beroende på sekvensen för den speciella hammarhuvud-ribozymkonstruktionen som mäts. Detta representerar en cirka 10 000-faldig hastighetsökning jämfört med den icke-enzymatiska klyvningen av RNA.
Krav på tvåvärda metalljoner
Alla ribozymer ansågs ursprungligen vara metallo-enzymer . Det antogs att tvåvärda metalljoner som Mg 2+ ansågs ha två roller: Främja korrekt veckning av RNA och att bilda den katalytiska kärnan. Eftersom RNA i sig inte innehöll tillräckligt med variation i de funktionella grupperna, ansågs metalljoner spela en roll på det aktiva stället, vilket var känt om proteiner. Den föreslagna mekanismen för Mg2+-jonen var: deprotoneringen av 2'-OH-gruppen av ett magnesium.aqua.hydroxikomplex bundet av pro-R-syren vid fosfatklyvningsstället, följt av nukleofil attack av den resulterande 2'- alkaoxid på det sprickbara fosfatet som bildar en pentakoordinat fosfatmellanprodukt. Det sista steget är avgången av den 5'-avgående gruppen, vilket ger ett 2',3'-cykliskt fosfat med en inverterad konfiguration.
Det antogs att hexahydratiserade magnesiumjoner , som existerar i jämvikt med magnesiumhydroxid , kunde spela rollerna som allmän syra och allmän bas , på ett sätt analogt med dem som spelas av två histidiner i RNas A. En ytterligare roll för tvåvärda metalljoner har också föreslagits i form av elektrostatisk stabilisering av övergångstillståndet .
Inte ett metallo-enzym
1998 upptäcktes det att hammarhuvudsribozymet, såväl som VS-ribozymet och hårnålsribozymet , inte kräver närvaron av metalljoner för katalys, förutsatt att en tillräckligt hög koncentration av envärd katjon är närvarande för att tillåta RNA:t att vika sig. Denna upptäckt antydde att RNA självt, snarare än att fungera som en inert, passiv ställning för bindning av kemiskt aktiva tvåvärda metalljoner, istället själv är intimt involverad i katalyskemin. De senaste strukturella resultaten, som beskrivs nedan, bekräftar verkligen att två invarianta nukleotider, G12 och G8, är placerade i överensstämmelse med rollerna som den allmänna basen och den allmänna syran i hammarhuvudets klyvningsreaktion.
Strängt taget kan därför hammarhuvudribozymet inte vara ett metallenzym.
Primär och sekundär struktur

Minimalt ribozym
Den minimala hammarhuvudsekvens som krävs för självklyvningsreaktionen inkluderar cirka 13 konserverade eller oföränderliga "kärn"-nukleotider, av vilka de flesta inte är involverade i att bilda kanoniska Watson-Crick-baspar . Kärnregionen flankeras av stammarna I, II och III, som i allmänhet är gjorda av kanoniska Watson-Crick-baspar men i övrigt inte är begränsade med avseende på sekvens. Den katalytiska omsättningshastigheten för minimala hammarhuvudribozymer är ~ 1/min (ett intervall på 0,1/min till 10/min observeras vanligtvis, beroende på de icke-konserverade sekvenserna och längden på de tre spiralformade stjälkarna) under standardreaktionsförhållanden med högt Mg 2 + (~10 mM), pH 7,5 och 25°C. Mycket av det experimentella arbete som utförts på hammarhuvud-ribozymer har använt en minimal konstruktion.
Typ I, typ II och typ III hammarhuvud-RNA
| Hammerhead-ribozym (typ I) | |
|---|---|
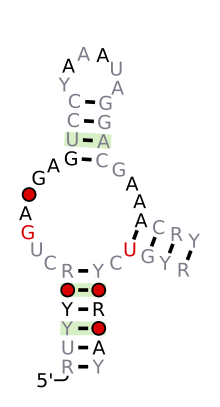 Förutspådd sekundär struktur och sekvenskonservering av Hammerhead_1
| |
| -identifierare | |
| Symbol | Hammerhead_1 |
| Rfam | RF00163 |
| Övriga uppgifter | |
| RNA -typ | Gen ; ribozym |
| Domän(er) | Viroider ; Eukaryota |
| SÅ | SO:0000380 |
| PDB- strukturer | PDBe |
| Hammerhead ribozym (typ III) | |
|---|---|
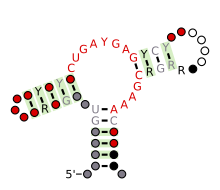 Förutspådd sekundär struktur och sekvenskonservering av Hammerhead ribozym (typ III)
| |
| Identifierare | |
| Symbol | Hammerhead_3 |
| Rfam | RF00008 |
| Övriga uppgifter | |
| RNA -typ | Gen ; ribozym |
| Domän(er) | Viroider ; Eukaryota |
| SÅ | SO:0000380 |
| PDB- strukturer | PDBe |
Strukturellt är hammarhuvud-ribozymet sammansatt av tre basparade helixar, åtskilda av korta länkar av konserverade sekvenser. Dessa spiraler kallas I, II och III. Hammarhead-ribozymer kan klassificeras i tre typer baserat på vilken helix 5'- och 3'-ändarna finns i. Om 5'- och 3'-ändarna av sekvensen bidrar till stam I så är det ett typ I-hammarhuvud-ribozym, till stam II är en typ II och till stam III så är det en typ III hammarhuvudsribozym. Av de tre möjliga topologiska typerna kan typ I hittas i genomen hos prokaryoter, eukaryoter och RNA-växtpatogener, medan typ II endast har beskrivits i prokaryoter och typ III mestadels finns i växter, växtpatogener och prokaryoter.
Fullängds ribozym
Hamarhuvudsribozymet i full längd består av ytterligare sekvenselement i skaft I och II som tillåter att ytterligare tertiära kontakter bildas. De tertiära interaktionerna stabiliserar den aktiva konformationen av ribozym, vilket resulterar i klyvningshastigheter upp till 1000 gånger högre än de för motsvarande minimala hammarhuvudsekvenser.
Tertiär struktur
Minimal
Det minimala hammarhuvudsribozymet har uttömmande studerats av biokemister och enzymologer såväl som av röntgenkristallografer, NMR-spektroskoper och andra utövare av biofysikaliska tekniker. Den första detaljerade tredimensionella strukturella informationen för ett hammarhuvudsribozym dök upp 1994 i form av en röntgenkristallstruktur av ett hammarhuvudribozym bundet till en DNA-substratanalog, publicerad i Nature av Pley, Flaherty och McKay . Därefter publicerades en minimal hammarhårig ribozymstruktur av RNA av Scott, Finch och Klug in Cell i början av 1995.
Det minimala hammarhuvud-ribozymet är sammansatt av tre basparade helixar, åtskilda av korta linkers av konserverad sekvens som visas i kristallstrukturen . Dessa spiraler kallas I, II och III. Den konserverade uridinvändningen länkar helix I till helix II och innehåller vanligtvis sekvensen CUGA. Helix II och III är länkade av en sekvens GAAA. Klyvningsreaktionen sker mellan helix III och I, och är vanligtvis en C.
Strukturen hos ett ribozym i full längd visar att det finns omfattande interaktioner mellan slingan av stam II och stam I.
Liknande strukturer observeras i andra ribozymer såsom ribozymer .
Struktur-funktion
Trots observationerna av hammarhuvudets ribozymkatalys i en kristall av den minimala hammarhuvudsekvensen där kristallgittrets packningskontakter av nödvändighet begränsade de globala positionerna för de distala ändarna av alla tre flankerande spiralformade stammar, många biokemiska experiment utformade för att undersöka interaktioner mellan övergångstillstånd och katalysens kemi verkade vara oförenlig med kristallstrukturerna.
Till exempel observerades de invarianta kärnresterna G5, G8, G12 och C3 i det minimala hammarhuvud-ribozymet var och en vara så ömtålig att förändring till och med en enda exocyklisk funktionell grupp på någon av dessa nukleotider resulterar i en dramatisk minskning eller avskaffande av katalytisk aktivitet Ändå verkade få av dessa bilda vätebindningar som involverade Watson-Crick-ytorna av dessa nukleotidbaser i någon av de minimala hammarhuvudstrukturerna, förutom en G-5-interaktion i produktstrukturen.
Ett särskilt slående och först nyligen observerat exempel bestod av G8 och G12, som identifierades som möjliga deltagare i syra/bas-katalys. När det väl visades att hammarhuvud-RNA inte kräver tvåvärda metalljoner för katalys, blev det gradvis uppenbart att RNA självt, snarare än passivt bundna tvåvärda metalljoner, måste spela en direkt kemisk roll i varje syra-baskemi i hammarhuvudets ribozym aktiv sida. Det var dock helt oklart hur G12 och G8 kunde åstadkomma detta, med tanke på de ursprungliga strukturerna för det minimala hammarhuvudsribozymet.
Andra bekymmer inkluderade en NOE mellan U4 och U7 av det kluvna hammarhuvud-ribozymet som också hade observerats under NMR- karakterisering, vilket antydde att dessa nukleotidbaser måste närma sig varandra närmare än cirka 6 Å, även om nära närmande av U7 till U4 inte verkade vara vara möjligt från kristallstrukturen. Slutligen, som tidigare diskuterats, var den attackerande nukleofilen i de ursprungliga strukturerna, 2'-OH av C17, inte i en position som var mottaglig för in-line-angrepp på det intilliggande klyvbara fosfatet .
Kanske mest oroande var experiment som antydde att A-9 och klyvbara fosfater måste komma inom cirka 4 Å från varandra i övergångstillståndet, baserat på dubbelfosforotioatsubstitution och räddningsexperiment med mjuka metalljoner; avståndet mellan dessa fosfater i den minimala hammarhuvudets kristallstruktur var cirka 18 Å, utan någon tydlig mekanism för närgång om stam II och stam I A-formade spiraler behandlades som stela kroppar. Sammantaget verkade dessa resultat tyda på att en ganska storskalig konformationsförändring måste ha skett för att nå övergångstillståndet inom den minimala hammarhuvudsribozymstrukturen.
Av dessa skäl verkade de två uppsättningarna av experiment (biokemiska vs. kristallografiska) inte bara vara motstridiga, utan att de var fullständigt och hopplöst oförenliga, vilket genererade en betydande oenighet på området. Inga övertygande bevis för att avfärda någon uppsättning av experimentella resultat har någonsin gjorts framgångsrikt, även om många påståenden om motsatsen gjordes till förmån för var och en.
Full längd
År 2006 erhölls en kristallstruktur med 2,2 Å upplösning av hammarhuvudsribozym i full längd. Denna nya struktur (visas till höger) verkar lösa de mest oroande av de tidigare avvikelserna. I synnerhet är C17 nu positionerad för in-line attack, och de invarianta resterna C3, G5, G8 och G12 verkar alla involverade i vitala interaktioner som är relevanta för katalys. Dessutom observeras A9 och klyvningsfosfaterna vara 4,3 Å från varandra, vilket överensstämmer med tanken att, när de modifierats, dessa fosfater skulle kunna binda en enda tiofil metalljon. Strukturen avslöjar också hur två invarianta rester, G-12 och G-8, är placerade inom det aktiva stället i överensstämmelse med deras tidigare föreslagna roll i syra/bas-katalys. G12 är inom vätebindningsavstånd till 2'–O av C17, nukleofilen i klyvningsreaktionen och ribosen av G8 vätebinder till den lämnande gruppen 5'-O. (se nedan), medan nukleotidbasen i G8 bildar ett Watson-Crick-par med den invarianta C3. Detta arrangemang tillåter en att föreslå att G12 är den allmänna basen i klyvningsreaktionen, och att G8 kan fungera som den allmänna syran, i överensstämmelse med tidigare biokemiska observationer. G5 väte binder till furanossyren i C17, vilket hjälper till att positionera det för in-line attack. U4 och U7, som en konsekvens av basparbildningen mellan G8 och C3, är nu placerade så att en NOE mellan deras baser lätt kan förklaras.
Kristallstrukturen hos hammarhuvudribozymet i full längd tar sålunda tydligt upp alla de stora problemen som verkade oförenliga med de tidigare kristallstrukturerna för det minimala hammarhuvudribozymet.
Struktur och katalys

De tertiära interaktionerna i hammarhuvudets ribozym i full längd stabiliserar vad som starkt verkar vara den aktiva konformationen. Nukleofilen, 2'-syren i klyvningsställesnukleotiden, C17, är inriktad nästan perfekt för en in-line attack (SN 2 (P)-reaktionen). G12 är placerad inom vätebindningsavstånd från denna nukleofil och skulle därför kunna abstrahera en proton från 2'-syren om G12 själv blir deprotonerad. 2'-OH i G8 bildar en vätebindning till den 5'-avgående gruppens syre, och kan därför potentiellt tillföra en proton när negativ laddning ackumuleras på 5'-syren i ribosen i A1.1.
Den mest troliga förklaringen är då att G12, i den deprotonerade formen, är den allmänna basen, och ribosen i G8 är den allmänna syran. Den skenbara kinetiska pKa [ förtydligande behövs ] för hammarhuvudribozymet är 8,5, medan pKa för guanosin är cirka 9,5. Det är möjligt att pKa för G12 är störd från 9,5 till 8,5 i hammarhuvudets katalytiska kärna; denna hypotes är för närvarande föremål för intensiv utredning.
Om den invarianta G8 ändras till C8, avskaffas hammarhuvudkatalysen. En dubbelmutant G8C + C3G som upprätthåller basparet G8-C3 som finns i hammarhuvudet i full längd återställer det mesta av den katalytiska aktiviteten. 2'-OH i G8 har också observerats vara väsentlig för katalys; ersättning av G8 med deoxyG8 minskar avsevärt katalyshastigheten, vilket tyder på att 2'-OH verkligen är avgörande för den katalytiska mekanismen.
Närheten till A9 och sprickbara fosfater kräver närvaron av en hög koncentration av positiv laddning. Detta är förmodligen källan till observationen att tvåvärda metalljoner krävs vid låg jonstyrka, men kan undvaras vid högre koncentrationer av envärda katjoner.
Reaktionen involverar således sannolikt borttagning av 2'-protonen från C17, följt av nukleofil attack på det intilliggande fosfatet. När bindningen mellan den klyvliga fosforn och den lämnande 5'-O-gruppen börjar bryta, tillförs en proton från ribosen av G8, som sedan sannolikt reprotoneras på bekostnad av en vattenmolekyl som observeras vätebinda till den i kristallstrukturen .
Terapeutiska applikationer
Modifierade hammarhuvud-ribozymer testas som terapeutiska medel. Syntetiska RNA som innehåller sekvenser som är komplementära till mutant SOD1 mRNA och sekvenser som är nödvändiga för att bilda hammarhuvudets katalytiska struktur studeras som en möjlig terapi för amyotrofisk lateralskleros . Arbete pågår också för att ta reda på om de skulle kunna användas för att konstruera HIV -resistenta linjer av T-celler. Modifierade hammarhuvud-ribozymadenovirus har visat sig vara potenta vid behandling av cancer både in vitro och in vivo.
Den terapeutiska användningen av trans -klyvande hammarhuvud-ribozymer har allvarligt hämmats av dess låga aktivitet in vivo . Den verkliga katalytiska potentialen hos transklyvande hammarhuvud-ribozymer kan återvinnas in vivo och terapeutiska derivat kommer sannolikt att komplettera andra nukleinsyrahybridiserande terapeutiska strategier. Det finns redan hammarhuvud-ribozymer som är nära klinisk tillämpning.
externa länkar
- Bill Scotts labbsidor om hammarhuvudets ribozym Arkiverad 2011-09-29 på Wayback Machine
- Marcos de la Peñas labbsida om hammarhuvudets ribozym
- Sida för Hammerhead typ I på Rfam
- Sida för Hammerhead typ II på Rfam
- Sida för Hammerhead typ III på Rfam
- Sida för Hammerhead HH9 på Rfam
- Sida för Hammerhead HH10 på Rfam