Fotoredoxkatalys
Fotoredoxkatalys är en gren av fotokemin som använder enelektronöverföring . Photoredox-katalysatorer hämtas i allmänhet från tre klasser av material: övergångsmetallkomplex, organiska färgämnen och halvledare . Medan organiska fotoredox-katalysatorer var dominerande under 1990-talet och början av 2000-talet, är lösliga övergångsmetallkomplex vanligare idag.
Fotokemi av övergångsmetallsensibilisatorer
Sensibilisatorer absorberar ljus för att ge redoxaktiva exciterade tillstånd. För många metallbaserade sensibilisatorer realiseras excitation som en metall-till-ligand-laddningsöverföring , varvid en elektron rör sig från metallen (t.ex. ad orbital) till en orbital lokaliserad på liganderna (t.ex. π* -orbitalen för en aromatisk ligand ). Det initiala exciterade elektroniska tillståndet slappnar av till det singlettexciterade tillståndet med lägsta energi genom intern omvandling , en process där energi försvinner som vibrationsenergi snarare än som elektromagnetisk strålning. Detta singlettexciterade tillstånd kan slappna av ytterligare genom två distinkta processer: katalysatorn kan fluorescera , utstråla en foton och återgå till singlett-grundtillståndet, eller så kan den flyttas till det exciterade tripletttillståndet med lägsta energi (ett tillstånd där två oparade elektroner har samma spinn) ) genom en andra icke-strålningsprocess som kallas intersystem crossing .
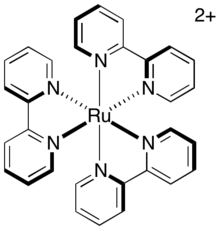
Direkt relaxation av den exciterade tripletten till grundtillståndet, kallad fosforescens , kräver både emission av en foton och inversion av den exciterade elektronens spinn. Denna väg är långsam eftersom den är spin-förbjuden så det triplettexciterade tillståndet har en avsevärd medellivslängd. För den vanliga fotosensibilisatorn, tris-(2,2'-bipyridyl)rutenium (förkortad som [Ru(bipy) 3 ] 2+ eller [Ru(bpy) 3 ] 2+ ), är livslängden för det triplettexciterade tillståndet ungefär 1100 ns. Denna livslängd är tillräcklig för att andra relaxationsvägar (särskilt elektronöverföringsvägar) ska inträffa innan katalysatorn sönderfaller till dess grundtillstånd.
Det långlivade triplettexciterade tillståndet som är tillgängligt genom fotoexcitation är både ett mer potent reduktionsmedel och ett mer potent oxidationsmedel än katalysatorns grundtillstånd. Eftersom sensibilisatorn är koordinativt mättad måste elektronöverföring ske genom en yttre sfärprocess, där elektrontunnlarna mellan katalysatorn och substratet.
Elektronöverföring från yttre sfär
Marcus teori om yttre sfärens elektronöverföring förutspår att en sådan tunnlingsprocess kommer att ske snabbast i system där elektronöverföringen är termodynamiskt gynnsam (dvs mellan starka reduktanter och oxidanter) och där elektronöverföringen har en låg inneboende barriär.
Den inneboende barriären för elektronöverföring härrör från Franck-Condon-principen , som säger att elektronisk övergång sker snabbare givet större överlappning mellan de initiala och slutliga elektroniska tillstånden. Löst tolkad antyder denna princip att barriären för en elektronisk övergång är relaterad till i vilken grad systemet försöker omorganisera. För en elektronisk övergång med ett system är barriären relaterad till "överlappningen" mellan den exciterade elektronens initiala och slutliga vågfunktioner – dvs i vilken grad elektronen behöver "röra sig" i övergången.
I en intermolekylär elektronöverföring spelas en liknande roll av graden till vilken kärnorna försöker röra sig som svar på förändringen i sin nya elektroniska miljö. Omedelbart efter elektronöverföring representerar molekylens kärnarrangemang, tidigare en jämvikt, nu ett vibrationsexciterat tillstånd och måste slappna av till sin nya jämviktsgeometri. Stela system, vars geometri inte är mycket beroende av oxidationstillståndet, upplever därför mindre vibrationsexcitation under elektronöverföring och har en lägre inneboende barriär. Fotokatalysatorer såsom [Ru(bipy) 3 ] 2+ hålls i ett styvt arrangemang av platta, tvåtandade ligander arrangerade i en oktaedrisk geometri runt metallcentrum. Därför genomgår komplexet inte mycket omorganisation under elektronöverföring. Eftersom elektronöverföringen av dessa komplex är snabb, kommer den sannolikt att äga rum inom varaktigheten av katalysatorns aktiva tillstånd, dvs under livstiden för det triplettexciterade tillståndet.
Katalysatorregenerering
För att regenerera grundtillståndet måste katalysatorn delta i en andra elektronöverföring från den yttre sfären. I många fall sker denna elektronöverföring med en stökiometrisk tvåelektronreduktant eller oxidant, även om detta steg i vissa fall involverar ett andra reagens.
Eftersom elektronöverföringssteget i den katalytiska cykeln sker från triplettexciterat tillstånd, konkurrerar det med fosforescens som en avslappningsväg. Stern–Volmer-experiment mäter intensiteten av fosforescens samtidigt som koncentrationen av varje möjligt släckmedel varieras. När koncentrationen av det faktiska släckmedlet varieras, påverkas hastigheten för elektronöverföring och graden av fosforescens. Detta förhållande modelleras av ekvationen:
00 Här betecknar jag och jag emissionsintensiteten med och utan släckmedel närvarande, k q hastighetskonstanten för släckningsprocessen, τ livslängden i exciterat tillstånd i frånvaro av släckmedel och [Q] koncentrationen av släckmedel. Sålunda, om livslängden i exciterat tillstånd för fotoredoxkatalysatorn är känd från andra experiment, kan hastighetskonstanten för släckning i närvaro av en enda reaktionskomponent bestämmas genom att mäta förändringen i emissionsintensitet när koncentrationen av släckmedel ändras.
Fotofysiska egenskaper
Redox potential
Redoxpotentialen för fotoredoxkatalysatorer måste anpassas till reaktionens övriga komponenter. Medan redoxpotentialer i grundtillstånd lätt kan mätas med cyklisk voltammetri eller andra elektrokemiska metoder, kan mätning av redoxpotentialen för ett elektroniskt exciterat tillstånd inte åstadkommas direkt med dessa metoder. Det finns emellertid två metoder som tillåter uppskattning av redoxpotentialerna i exciterat tillstånd och en metod finns för direkt mätning av dessa potentialer. För att uppskatta redoxpotentialerna i exciterat tillstånd är en metod att jämföra hastigheterna för elektronöverföring från det exciterade tillståndet till en serie av grundtillståndsreaktanter vars redoxpotentialer är kända. En vanligare metod för att uppskatta dessa potentialer är att använda en ekvation utvecklad av Rehm och Weller som beskriver de exciterade potentialerna som en korrigering av grundtillståndspotentialerna:
I dessa formler representerar E* 1/2 reduktionen eller oxidationspotentialen för det exciterade tillståndet, E 1/2 representerar grundtillståndets reduktion eller oxidationspotential, E 0,0 representerar skillnaden i energi mellan de nollte vibrationstillstånden av marken och exciterade tillstånd och w r representerar arbetsfunktionen , en elektrostatisk interaktion som uppstår på grund av separationen av laddningar som sker under elektronöverföring mellan två kemiska arter. Excitationsenergin noll-noll, E 0,0 , approximeras vanligtvis av motsvarande övergång i fluorescensspektrumet. Denna metod tillåter beräkning av ungefärliga redoxpotentialer i exciterat tillstånd från mer lättmätta redoxpotentialer i grundtillstånd och spektroskopiska data.
Direkt mätning av redoxpotentialerna i exciterat tillstånd är möjlig genom att tillämpa en metod som kallas fasmodulerad voltammetri . Denna metod fungerar genom att lysa ljus på en elektrokemisk cell för att generera de önskade arterna i exciterat tillstånd, men för att modulera ljusets intensitet sinusformigt , så att koncentrationen av arterna i exciterat tillstånd inte är konstant. Faktum är att koncentrationen av arter i exciterat tillstånd i cellen bör ändras exakt i fas med intensiteten av ljus som faller in på den elektrokemiska cellen. Om potentialen som appliceras på cellen är tillräckligt stark för att elektronöverföring ska ske, kan förändringen i koncentrationen av det redoxkompetenta exciterade tillståndet mätas som en växelström (AC). Dessutom motsvarar fasförskjutningen av växelströmsströmmen i förhållande till intensiteten av det infallande ljuset den genomsnittliga livslängden för en art i exciterat tillstånd innan den engagerar sig i elektronöverföring.
Diagram över redoxpotentialer för de vanligaste fotoredoxkatalysatorerna finns tillgängliga för snabb åtkomst.
Ligandelektronegativitet
De relativa reducerande och oxiderande egenskaperna hos dessa fotokatalysatorer kan förstås genom att beakta ligandernas elektronegativitet och katalysatorkomplexets metallcentrum. Fler elektronegativa metaller och ligander kan stabilisera elektroner bättre än deras mindre elektronegativa motsvarigheter. Därför är komplex med fler elektronegativa ligander mer oxiderande än mindre elektronegativa ligandkomplex. Till exempel är liganderna 2,2'-bipyridin och 2,2'-fenylpyridin isoelektroniska strukturer som innehåller samma antal och arrangemang av elektroner. Fenylpyridin ersätter en av kväveatomerna i bipyridin med en kolatom. Kol är mindre elektronegativt än kväve är, så det håller elektroner mindre tätt. Eftersom resten av ligandmolekylen är identisk och fenylpyridin håller elektroner mindre tätt än bipyridin, är den starkare elektrondonerande och mindre elektronegativ som en ligand. Följaktligen är komplex med fenylpyridinligander kraftigare reducerande och mindre starkt oxiderande än ekvivalenta komplex med bipyridinligander.
På liknande sätt är en fluorerad fenylpyridinligand mer elektronegativ än fenylpyridin så komplex med fluorinnehållande ligander är starkare oxiderande och mindre starkt reducerande än ekvivalenta osubstituerade fenylpyridinkomplex. Metallcentrets elektroniska påverkan på komplexet är mer komplex än ligandeffekten. Enligt Pauling-skalan för elektronegativitet har både rutenium och iridium en elektronegativitet på 2,2. Om detta var den enda faktorn som är relevant för redoxpotentialer, borde komplex av rutenium och iridium med samma ligander vara lika kraftfulla fotoredoxkatalysatorer. Men med tanke på Rehm-Wellers ekvation spelar metallens spektroskopiska egenskaper en roll för att bestämma redoxegenskaperna för det exciterade tillståndet. Speciellt är parametern E 0,0 relaterad till komplexets emissionsvåglängd och därför till storleken på Stokes-skiftet - skillnaden i energi mellan maximal absorption och emission av en molekyl. Vanligtvis har ruteniumkomplex stora Stokes-skift och följaktligen lågenergiemissionsvåglängder och små noll-noll excitationsenergier jämfört med iridiumkomplex. I själva verket, medan grundtillståndsruteniumkomplex kan vara potenta reduktanter, är det exciterade tillståndskomplexet ett mycket mindre potent reduktionsmedel eller oxidant än dess ekvivalenta iridiumkomplex. Detta gör iridium att föredra för utvecklingen av allmänna organiska transformationer eftersom de starkare redoxpotentialerna hos den exciterade katalysatorn tillåter användningen av svagare stökiometriska reduktionsmedel och oxidanter eller användningen av mindre reaktiva substrat.
Motjonsidentitet
Det är ofta så att dessa fotokatalysatorer balanseras med en motjon, vilket är fallet med exemplet med komplexet tris-(2,2'-bipyridyl)rutenium som åtföljs av två anjoner för att balansera den totala laddningen av jonparet till noll. Det finns dock övergångsmetallfotoredoxkatalysatorer som existerar utan en motjon såsom tris(2-fenylpyridin)iridium (ofta förkortat Ir(ppy) 3 ). Betydelsen av dessa motjoner är beroende av jonassociationen mellan fotoredoxkatalysatorn och dess motjon(er) och är beroende av lösningsmedlet som används för reaktionen. Även om fotofysiska egenskaper som redoxpotential, excitationsenergi och ligandelektronegativ ofta har ansetts vara nyckelparametrar för användning och reaktivitet av dessa komplex, har motjonidentitet visat sig spela en betydande roll i lösningsmedel med låg polaritet . Speciellt har det visat sig att att ha en tätt associerad motjon ökar elektronöverföringshastigheten vid reducering av ett substrat men reducerar avsevärt hastigheten för elektronöverföring vid oxidation av ett substrat. Detta antas inträffa eftersom motjonen väsentligen "blockerar" elektronöverföringen till fotoredoxkomplexet genom att avskärma det mer positivt laddade området av komplexet; medan den täta motjonassociationen skjuter elektrontätheten längre från fotoredoxkatalysatorns metallcentrum, vilket gör det lättare att överföras från katalysatorn (naturligtvis gäller detta endast i det fall där fotoredoxkatalysatorn är en katjon och räknaren -jon är en anjon ). Motjonsidentitet är således en ytterligare parameter att ta hänsyn till när man utvecklar nya fotoredoxreaktioner.
Ansökningar
Reduktiv dehalogenering
Den tidigaste tillämpningen av fotoredoxkatalys för reduktiv dehalogenering begränsades av snäv substratomfattning eller konkurrerande reduktiv koppling.
Oaktiverade kol-jodbindningar kan reduceras med den starkt reducerande fotokatalysatorn tris-(2,2'- fenylpyridin )iridium (Ir(ppy) 3 ). Den ökade reduktionspotentialen för Ir(ppy) 3 jämfört med [Ru(bipy) 3 ] 2+ tillåter direkt reduktion av kol-jodbindningen utan att interagera med en stökiometrisk reduktionsmedel. Således överför iridiumkomplexet en elektron till substratet, vilket orsakar fragmentering av substratet och oxiderar katalysatorn till Ir(IV)-oxidationstillståndet. Den oxiderade fotokatalysatorn återförs till sitt ursprungliga oxidationstillstånd genom att oxidera en reaktionstillsats.
Liksom tennmedierade radikaldehalogeneringsreaktioner kan fotokatalytisk reduktiv dehalogenering användas för att initiera kaskadcykliseringar
Oxidativ generering av iminiumjoner
Iminiumjoner är potenta elektrofiler användbara för att generera CC-bindningar i komplexa molekyler. Kondensationen av aminer med karbonylföreningar för att bilda iminiumjoner är emellertid ofta ogynnsam, vilket ibland kräver hårda uttorkningsförhållanden. Sålunda är alternativa metoder för generering av iminiumjoner, särskilt genom oxidation från motsvarande amin, ett värdefullt syntesverktyg. Iminiumjoner kan genereras från aktiverade aminer med hjälp av Ir(dtbbpy)(ppy) 2 PF 6 som en fotoredox-katalysator. Denna omvandling föreslås ske genom oxidation av aminen till aminiumradikalkatjonen av den exciterade fotokatalysatorn . Detta följs av väteatomöverföring till en superstökimetrisk oxidant, såsom triklormetylradikal (CCl3 för att bilda iminiumjonen). Iminiumjonen släcks sedan genom reaktion med en nukleofil. Besläktade transformationer av aminer med ett stort antal andra nukleofiler har undersökts, såsom cyanid ( Strecker-reaktion ), silylenoleter ( Mannich-reaktion ), dialkylfosfater, allylsilaner (aza- Sakurai-reaktion ), indoler ( Friedel-Crafts-reaktion ), och kopparacetylider.
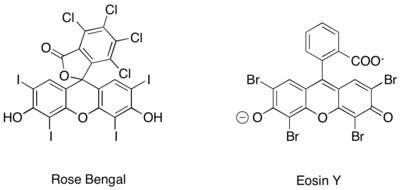
organiska fotoredoxkatalysatorer, såsom Rose Bengal och Eosin Y.
En asymmetrisk variant av denna reaktion använder acylnukleofila ekvivalenter genererade genom N-heterocyklisk karbenkatalys . Denna reaktionsmetod kringgår problemet med dålig enantioinduktion från kirala fotoredoxkatalysatorer genom att flytta källan för enantioselektivitet till den N-heterocykliska karbenen.
Oxidativ generering av oxokarbeniumjoner
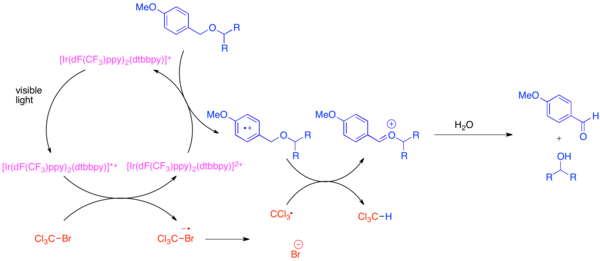
Utvecklingen av ortogonala skyddsgrupper är ett problem vid organisk syntes eftersom dessa skyddsgrupper tillåter att varje instans av en gemensam funktionell grupp, såsom hydroxylgruppen, kan särskiljas under syntesen av en komplex molekyl. En mycket vanlig skyddsgrupp för den funktionella hydroxylgruppen är para -metoxibensyl (PMB)-etern. Denna skyddsgrupp är kemiskt lik den mindre elektronrika bensyletern. Vanligtvis använder selektiv klyvning av en PMB-eter i närvaro av en bensyleter starka stökiometriska oxidanter såsom 2,3-diklor-5,6-dicyano-1,4-bensokinon (DDQ) eller ceriumammoniumnitrat (CAN). PMB-etrar är mycket mer mottagliga för oxidation än bensyletrar eftersom de är mer elektronrika. Den selektiva avskyddningen av PMB-etrar kan uppnås genom användning av bis-(2-(2',4'-difluorfenyl)-5-trifluormetylpyridin)-(4,4'-ditertbutylbipyridin)iridium(III)hexafluorfosfat (Ir[dF) (CF3 ) ppy] 2 (dtbbpy)PF6 ) och en mild stökiometrisk oxidant såsom bromtriklormetan, BrCCl3 . Den fotoexciterade iridiumkatalysatorn reducerar tillräckligt för att fragmentera bromtriklormetanen för att bilda en triklormetylradikal, bromidanjon och Ir(IV)-komplexet. De elektronfattiga fluorerade liganderna gör att iridiumkomplexet oxiderar tillräckligt för att acceptera en elektron från en elektronrik arena såsom en PMB-eter. Efter att arenen har oxiderats kommer den lätt att delta i väteatomöverföringen med triklormetylradikal för att bilda kloroform och en oxokarbeniumjon , som lätt hydrolyseras för att avslöja den fria hydroxiden. Denna reaktion visades vara ortogonal mot många vanliga skyddsgrupper när en bas tillsattes för att neutralisera producerad HBr.
Cykelladdningar
Cycladditions och andra pericykliska reaktioner är kraftfulla transformationer i organisk syntes på grund av deras potential att snabbt generera komplexa molekylära arkitekturer och särskilt på grund av deras förmåga att ställa in flera intilliggande stereocenter på ett mycket kontrollerat sätt. Endast vissa cykloadditioner är dock tillåtna under termiska förhållanden enligt Woodward-Hoffmann-reglerna för orbitalsymmetri, eller andra likvärdiga modeller såsom frontier molecular orbital theory (FMO) eller Dewar-Zimmermann-modellen. Cykloadditioner som inte är termiskt tillåtna, såsom [2+2]-cykloaddition, kan aktiveras genom fotokemisk aktivering av reaktionen. Under okatalyserade förhållanden kräver denna aktivering användning av högenergi ultraviolett ljus som kan förändra orbitalpopulationerna för de reaktiva föreningarna. Alternativt har metallkatalysatorer som kobolt och koppar rapporterats katalysera termiskt förbjudna [2+2] cykloadditioner via enkelelektronöverföring.
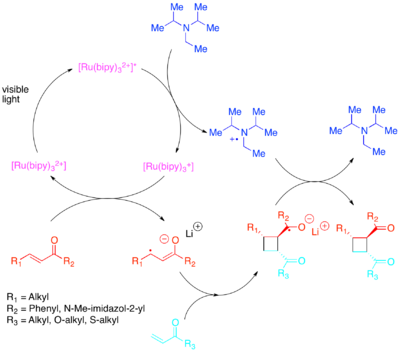
Den erforderliga förändringen i orbitala populationer kan uppnås genom elektronöverföring med en fotokatalysator som är känslig för synligt ljus med lägre energi. Yoon visade de effektiva intra- och intermolekylära [2+2] cykloadditionerna av aktiverade olefiner : speciellt enoner och styrener. Enoner, eller elektronfattiga olefiner, upptäcktes reagera via en radikal-anjonväg, med användning av diisopropyletylamin som en övergående elektronkälla. För denna elektronöverföring upptäcktes [Ru(bipy) 3 ] 2+ vara en effektiv fotokatalysator. Cykliseringens anjoniska natur visade sig vara avgörande: att utföra reaktionen i syra snarare än med en litiummotjon gynnade en icke-cykloadditionsväg. Zhao et al. upptäckte också att en fortfarande annan cykliseringsväg är tillgänglig för chalconer med en samariummotjon . Omvänt visade sig elektronrika styrener reagera via en radikalkatjonmekanism, med användning av metylviolen eller molekylärt syre som en transient elektronsänka. Även om [Ru(bipy) 3 ] 2+ visade sig vara en kompetent katalysator för intramolekylära cykliseringar med användning av metylviolen , kunde den inte användas med molekylärt syre som en elektronsänka eller för intermolekylära cykliseringar. För intermolekylära cykliseringar, Yoon et al. upptäckte att den starkare oxiderande fotokatalysatorn [Ru(bpm) 3 ] 2+ och molekylärt syre gav ett katalytiskt system som var bättre lämpat för att komma åt den radikalkatjon som är nödvändig för att cykloadditionen ska inträffa. [Ru(bpz) 3 ] 2+ , en ännu starkare oxiderande fotokatalysator, visade sig vara problematisk eftersom den, även om den kunde katalysera den önskade [2+2] cykloadditionen, också var tillräckligt stark för att oxidera cykloaddukten och katalysera retro-[ 2+2] reaktion. Denna jämförelse av fotokatalysatorer belyser vikten av att anpassa redoxegenskaperna hos en fotokatalysator till reaktionssystemet samt demonstrera värdet av polypyridylföreningar som ligander, på grund av den lätthet med vilken de kan modifieras för att justera redoxegenskaperna hos deras komplex.
Fotoredox-katalyserade [2+2]-cykloadditioner kan också utföras med en organisk trifenylpyrylium-fotoredoxkatalysator.
Förutom den termiskt förbjudna [2+2]-cykloadditionen kan fotoredox-katalys tillämpas på [4+2]-cykliseringen ( Diels–Alder-reaktionen) . Bis-enoner, liknande de substrat som används för fotoredox [2+2]-cyklisering, men med en längre länk som förenar de två funktionella enongrupperna, genomgår intramolekylära radikal-anjon-hetero-Diels-Alder-reaktioner snabbare än [2+2] cykloaddition.
På liknande sätt deltar elektronrika styrener i intra- eller intermolekylära Diels–Alder-cykliseringar via en radikal katjonmekanism. [Ru(bipy) 3 ] 2+ var en kompetent katalysator för intermolekylära, men inte intramolekylära, Diels–Alder-cykliseringar. Denna fotoredox-katalyserade Diels-Alder-reaktion tillåter cykloaddition mellan två elektroniskt felaktiga substrat. Den normala elektroniska efterfrågan på Diels–Alder-reaktionen kräver att en elektronrik dien reagerar med en elektronfattig olefin (eller "dienofil"), medan den omvända elektronefterfrågan Diels–Alder-reaktionen äger rum mellan det motsatta fallet av en elektronfattig dien och en mycket elektronrik dienofil. Fotoredoxfallet, eftersom det sker genom en annan mekanism än den termiska Diels–Alder-reaktionen, tillåter cykloaddition mellan en elektronrik dien och en elektronrik dienofil, vilket ger tillgång till nya klasser av Diels–Alder-addukter.
Det syntetiska värdet av Yoons fotoredox-katalyserade styren Diels-Alder-reaktion demonstrerades via den totala syntesen av naturprodukten Heitziamide A. Denna syntes visar att den termiska Diels-Alder-reaktionen gynnar den oönskade regioisomeren, men den fotoredox-katalyserade reaktionen ger den önskade regioisomer i förbättrat utbyte.
Fotoredox organokatalys
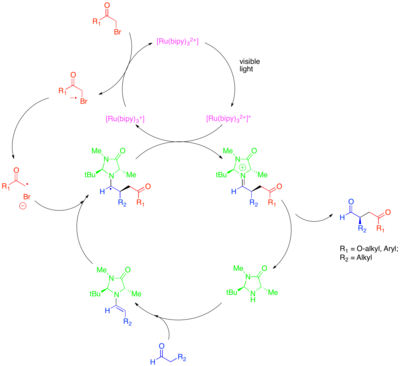
Organokatalys är ett underområde av katalys som utforskar potentialen hos organiska små molekyler som katalysatorer, särskilt för enantioselektivt skapande av kirala molekyler. En strategi inom detta delområde är användningen av kirala sekundära aminer för att aktivera karbonylföreningar. I detta fall genererar aminkondensation med karbonylföreningen en nukleofil enamin . Den kirala aminen är utformad så att en yta av enaminen är steriskt skärmad och så att endast den oskärmade ytan är fri att reagera. Trots kraften i detta tillvägagångssätt för att katalysera den enantioselektiva funktionaliseringen av karbonylföreningar, förblev vissa värdefulla transformationer, såsom den katalytiska enantioselektiva a-alkyleringen av aldehyder , svårfångade. Kombinationen av organokatalys och fotoredoxmetoder ger en katalytisk lösning på detta problem. I detta tillvägagångssätt för a-alkylering av aldehyder, fragmenterar [Ru(bipy) 3 ] 2+ reduktivt en aktiverad alkylhalid, såsom bromomalonat eller fenacylbromid , som sedan kan adderas till katalytiskt genererad enamin på ett enantioselektivt sätt. Den oxiderade fotokatalysatorn släcker sedan oxidativt den resulterande a-aminoradikalen för att bilda en iminiumjon, som hydrolyserar för att ge den funktionaliserade karbonylföreningen. Denna fotoredox-transformation visade sig vara mekaniskt skild från en annan organokatalytisk radikalprocess som kallas enkelupptagen molekylär orbital (SOMO) katalys. SOMO-katalys använder superstökiometriskt cerisk ammoniumnitrat (CAN) för att oxidera den katalytiskt genererade enaminen till motsvarande radikalkatjon, som sedan kan läggas till en lämplig kopplingspartner såsom allylsilan. Denna typ av mekanism är utesluten för den fotokatalytiska alkyleringsreaktionen, eftersom medan enaminradikalkatjon observerades att cyklisera på vidhängande olefiner och öppna cyklopropanradikalklockor i SOMO-katalys, var dessa strukturer oreaktiva i fotoredoxreaktionen.
Denna omvandling inkluderar alkyleringar med andra klasser av aktiverade alkylhalider av syntetiskt intresse. I synnerhet tillåter användningen av fotokatalysatorn Ir(dtbbpy)(ppy) 2+ enantioselektiv a-trifluormetylering av aldehyder medan användningen av Ir(ppy) 3 möjliggjorde enantioselektiv koppling av aldehyder med elektronfattiga bensyliska bromider. Zeitler et al. undersökte också den produktiva sammanslagning av fotoredox och organokatalytiska metoder för att uppnå enantioselektiv alkylering av aldehyder. Samma kirala imidazolidinonorganokatalysator användes för att bilda enamin och införa kiralitet. Emellertid användes den organiska fotoredoxkatalysatorn Eosin Y snarare än ett rutenium- eller iridiumkomplex.
Direkt β-arylering av mättade aldehyder och ketoner kan åstadkommas genom kombinationen av fotoredox och organokatalytiska metoder. Den tidigare metoden för att åstadkomma direkt β-funktionalisering av en mättad karbonyl består av en enkärl består av en tvåstegsprocess, båda katalyserad av en sekundär aminorganokatalysator: stökiometrisk reduktion av en aldehyd med IBX följt av tillsats av en aktiverad alkylnukleofil till betapositionen för den resulterande enalen . Denna omvandling, som liksom andra fotoredoxprocesser sker genom en radikal mekanism, är begränsad till tillsatsen av mycket elektrofila arener till betapositionen. De allvarliga begränsningarna av arenkomponentens omfattning i denna reaktion beror främst på behovet av en arenradikalanjon som är tillräckligt stabil för att inte reagera direkt med enamin- eller enaminradikalkatjon. I den föreslagna mekanismen släcks den aktiverade fotoredox-katalysatorn oxidativt av en elektron-defekt are, såsom 1,4-dicyanobensen . Fotokatalysatorn oxiderar sedan en enaminart, som övergående genereras genom kondensation av en aldehyd med en sekundär aminsamkatalysator, såsom den optimala isopropylbensylaminen. Den resulterande enaminradikalkatjonen reagerar vanligtvis som ett 3 π-elektronsystem, men på grund av stabiliteten hos radikalkopplingspartnerna ger deprotonering av β-metylenpositionen upphov till ett 5 π-elektronsystem med stark radikalkaraktär vid den nyligen åtkomliga p-kol. Även om denna reaktion är beroende av användningen av en sekundär aminorganokatalysator för att generera enaminspecies som oxideras i den föreslagna mekanismen, existerar ingen enantioselektiv variant av denna reaktion.
Utvecklingen av denna direkta β-arylering av aldehyder ledde till relaterade reaktioner för β-funktionaliseringen av cykliska ketoner. I synnerhet har p-arylering av cykliska ketoner uppnåtts under liknande reaktionsbetingelser, men med användning av azepan som sekundär aminsamkatalysator. En fotokatalytisk "homo-aldol"-reaktion fungerar för cykliska ketoner, vilket möjliggör koppling av ketonens beta-position till ipso-kolet av arylketoner, såsom bensofenon och acetofenon . Förutom azepan-samkatalysatorn kräver denna reaktion användning av den starkare reducerande fotoredoxkatalysatorn Ir(ppy) 3 och tillsats av litiumhexafluorarsenid (LiAsF6) för att främja enelektronreduktion av arylketonen.
Tillsatser till olefiner
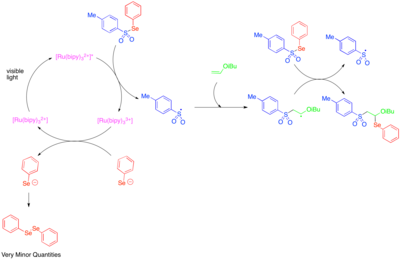
Användningen av fotoredoxkatalys för att generera reaktiva heteroatomcentrerade radikaler undersöktes först på 1990-talet. [Ru(bipy) 3 ] 2+ visade sig katalysera fragmenteringen av tosylfenylselenid till fenylselenolatanjon och tosylradikal och att en radikalkedjeutbredningsmekanism möjliggjorde tillsats av tosylradikal och fenylselenoradikal över dubbelbindningen av elektronrika alkylvinyler. . Eftersom fenylselenolatanjon lätt oxideras till difenyldiselenid, togs de låga mängderna difenyldiselenid som observerades som en indikation på att fotoredox-katalyserad fragmentering av tosylfenylselenid endast var viktigt som ett initieringssteg och att det mesta av reaktiviteten berodde på en radikalprocess.
Heteroaromatiska tillsatser till olefiner inkluderar multikomponent-oxi- och aminotrifluormetyleringsreaktioner. Dessa reaktioner använder Umemotos reagens, ett sulfoniumsalt som fungerar som en elektrofil källa för trifluorometylgruppen och som har prejudikat reagerar via en enkelelektronöverföringsväg. Således frisätter en-elektronreduktion av Umemotos reagens trifluormetylradikal, som adderar till den reaktiva olefinen. Därefter producerar enkelelektronoxidation av alkylradikalen som genereras genom denna tillsats en katjon som kan fångas av vatten, en alkohol eller en nitril. För att uppnå höga nivåer av regioselektivitet har denna reaktivitet undersökts främst för styrener, som är partiska mot bildning av bensylradikalintermediären.
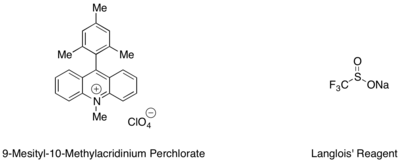
Hydrotrifluormetylering av styrener och alifatiska alkener kan utföras med en mesitylakridinium organisk fotoredoxkatalysator och Langlois' reagens som källa till CF3- radikal . I denna reaktion fann man att trifluoretanol och substökiometriska mängder av en aromatisk tiol, såsom metyltiosalicylat, som användes i tandem, tjänade som den bästa källan till väteradikal för att fullborda den katalytiska cykeln.
Intramolekylära hydroeterifieringar och hydroamineringar fortsätter med anti-Markovnikov-selektivitet. En mekanism framkallar enkel-elektronoxidationen av olefinen, fångar radikalkatjonen av en vidhängande hydroxyl- eller aminfunktionell grupp och släcker den resulterande alkylradikalen genom H-atomöverföring från en mycket labil donatorart. Utvidgning av denna reaktivitet till intermolekylära system har resulterat i i) en ny syntesväg till komplexa tetrahydrofuraner genom en "polär-radikal-korsningscykloaddition" (PRCC-reaktion) av en allylalkohol med en olefin, och ii) anti-Markovnikov-tillsatsen av karboxylsyror till olefiner.


![\left({\frac {I_{0}}{I}}\right)=1+{k_{q}}*{\tau _{0}}\times [Q]](https://wikimedia.org/api/rest_v1/media/math/render/svg/338eb04d84052783d691791ccf5c329070594aa0)