Elexacaftor/tezacaftor/ivacaftor
| Kombination av | |
|---|---|
| Elexacaftor | för cystisk fibros transmembrankonduktansregulator (CFTR). |
| Tezacaftor | CFTR-korrigerare |
| Ivacaftor | Kloridkanalöppnare |
| Kliniska data | |
| Handelsnamn | Trikafta, Kaftrio |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a619061 |
| Licensdata | |
Graviditetskategori _ |
|
Administreringsvägar _ |
Via mun |
| ATC-kod | |
| Rättslig status | |
| Rättslig status | |
| Identifierare | |
| CAS-nummer | |
| KEGG | |
Elexacaftor/tezacaftor/ivacaftor , som säljs under varumärkena Trikafta (USA) och Kaftrio (EU), är ett kombinationsläkemedel med fast dos som används för att behandla cystisk fibros . Elexacaftor/tezacaftor/ivacaftor är sammansatt av en kombination av ivacaftor , en kloridkanalöppnare, och elexacaftor och tezacaftor , CFTR-modulatorer.
Det är godkänt för användning i USA för personer i åldern sex år och äldre som har cystisk fibros med en F508del-mutation eller andra mutationer i CFTR-genen. Den är också godkänd för användning i Kanada, EU och Australien. Listpriset för ett års behandling i USA är 311 000 USD .
Medicinsk användning
Kombinationen är indicerad för behandling av personer i åldern sex år och äldre som har cystisk fibros med en F508del-mutation eller andra mutationer i CFTR-genen.
Bieffekter
De vanligaste biverkningarna som drabbar mer än 5 % av patienterna är huvudvärk, övre luftvägsinfektion, buksmärtor, diarré , utslag , ökning av alaninaminotransferas , nästäppa , ökning av kreatinfosfokinas i blodet, ökning av aspartataminotransferas, rinorré , sinus , rinit , influensa och blodbilirubinökning.
Interaktioner
Samtidig användning med CYP3A- inducerare rekommenderas inte. Dosen måste justeras med måttliga eller starka CYP3A- hämmare.
Andra läkemedel med potential för interaktion inkluderar: warfarin , digoxin , statiner , glyburid , nateglinid , repaglinid .
Farmakologi
Cystisk fibros och CFTR
Cystisk fibros är en autosomal recessiv genetisk störning av CFTR-proteinet som minskar transporten av klorid och natriumjoner genom cellmembranet, vilket orsakar sekret som är tjockare än normalt. CFTR-proteinet finns i epitelceller i lungan, levern, bukspottkörteln, matsmältningskanalen och fortplantningsorganen. CFTR har en roll i produktionen av slem, svett och matsmältningsvätskor. Det förtjockade slemmet kan leda till inflammation, luftvägsinfektioner och tilltäppta kanaler.
Handlingsmekanism
Elexacaftor/tezacaftor/ivacaftor är en tridrug behandling där medicinerna samverkar för att öka transporten av klorid- och natriumjoner och korrigera vätskeförskjutningar som är oreglerade vid cystisk fibros.
CFTR-kanalpotentiator
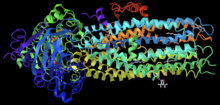
Ivacaftor är en selektiv förstärkare av små molekyler av CFTR -proteinet som ökar proteinets förmåga att öppna kloridkanaler. Dess effektivitet är starkt beroende av mängden CFTR-protein på cellytan och känsligheten hos det mutanta CFTR-proteinet. Ivacaftors primära mål är att behandla klass III CFTR-styrningsmutationer som G551D såväl som andra mindre vanliga mutationer. I den kristallina figuren kan du se ivacaftor, visad som en grå boll och stickmodell längst ner till höger, bunden till CFTR dockad i en klyfta som bildas av transmembranspiraler vid protein-lipidgränssnittet.
CFTR-korrigerare
Elexacaftor och Tezacaftor fungerar som CFTR-korrektorer för att reparera F508del-bearbetning genom att binda till CFTR-proteinet för att öka tillgängligheten av CFTR-protein på cellytan. De fungerar genom att modulera positionen för CFTR-proteinet till rätt position på cellytan.
Kombinationen av ökat CFTR-protein i rätt position på cellytan med ivacaftors förstärkning av kloridkanalöppning resulterar i ökad transport av klorid och uttunnade slemsekret.
Farmakokinetik
Elexacaftor/tezacaftor/ivacaftor metaboliseras primärt av CYP3A4 /5 . Denna medicin bör tas med en måltid med hög fetthalt för att förbättra absorptionen genom tarmen. Det utsöndras som metaboliter eller oförändrat huvudsakligen via avföring och i mindre utsträckning urin. Den genomsnittliga effektiva halveringstiden för elexacaftor, tezacaftor och ivacaftor är 27,4 timmar, 25,1 timmar respektive 15 timmar.
Historia
En fas III- studie visade att personer som behandlats med elexacaftor/tezacaftor/ivacaftor förbättrade FEV1 efter fyra veckor med ihållande förbättring efter 24 veckor. Frekvensen av pulmonell exacerbation var 63 % lägre och svettkloridkoncentrationen var 41,8 mmol/L lägre. Dess effektivitet beror på vilken typ av CF-mutationer patienten har.
Samhälle och kultur
Rättslig status
Förenta staterna
Kombinationen godkändes för användning i USA 2019, för personer tolv år och äldre med cystisk fibros som har minst en F508del-mutation i genen för transmembrankonduktansregulator för cystisk fibros (CFTR), som uppskattas representera 90 % av cystisk fibros population. I december 2020, efter att ytterligare en klinisk prövning slutförts, och FDA-godkännande utökades för 177 andra mutationer av cystisk fibros. FDA-godkännande för barn i åldrarna 6–11 tillkom i januari 2021, efter att en tredje klinisk prövning slutförts.
US Food and Drug Administration (FDA) beviljade ansökan prioriterad granskning , förutom snabbspår , banbrytande terapi och särläkemedelsbeteckningar . Läkemedlets tillverkare Vertex Pharmaceuticals kommer att få en kupong för prioritetsgranskning av sällsynta barnsjukdomar för att ha utvecklat denna terapi.
Australien
I mars 2021 godkände hälsotillsynsmyndigheter i Australien kombinationen för personer i åldern 12 år och äldre med minst en kopia av F508del-mutationen. I slutet av april 2022 placerades den på Pharmaceutical Benefits Scheme , vilket minskade kostnaden från tiotusentals dollar i månaden till tiotusentals dollar i månaden.
Kanada
I juni 2020 godkände Health Canada kombinationen för personer som är 12 år och äldre. I september 2021 meddelade provinserna Alberta och Saskatchewan att de kommer att gå med i Ontario för att finansiera medicinen. De kommer att avgöra täckning från fall till fall med hjälp av kriterier som ännu inte har meddelats.
europeiska unionen
I juni 2020 rekommenderade kommittén för läkemedel för humant bruk (CHMP) vid Europeiska läkemedelsmyndigheten (EMA) godkännande av kombinationen för behandling av cystisk fibros. Den godkändes för medicinsk användning i EU i augusti 2020.
Norge
Den 25 april 2022 godkände Beslutningsforum for nye metoder kombinationen för behandling av cystisk fibros.
Nya Zeeland
I februari 2022 rekommenderade Pharmac , med medelhög prioritet, finansiering för personer som är 12 år och äldre. I december 2022 meddelade Pharmac att de hade nått ett provisoriskt avtal med Vertex som finansierar Trikafta från och med den 1 april 2023 för patienter i åldern sex eller äldre.
Spanien
I november 2021 godkände den spanska regeringen återbetalningen av kombinationen för personer som är 12 år och äldre med minst en kopia av F508del-mutationen.
Ekonomi
Förenta staterna
Listpriset för ett års behandling i USA är 311 000 USD . En rapport från 2020 från Institute for Clinical and Economic Review fann dock att priset har gjort behandlingen inte kostnadseffektiv och att "ett lämpligt pris för hälsofördelar skulle variera från $67 900–85 500 $ per år".
Australien
Efter noteringen av kombinationen på Pharmaceutical Benefits Scheme 2022 är kostnaden för CF-patienter 12 år eller äldre som har minst en F508del-mutation i transmembrankonduktansregulatorgenen för cystisk fibros 42,50 USD per månad, eller 6,80 USD för koncessionskort hållare.
Kontrovers
Vertex avböjer att göra kombinationen tillgänglig i utvecklingsländer och arbetar för att blockera generiska alternativ.
Forskning
| Rättegång | Typ | Primär slutpunkt | Målålder | Målmutationer | Resultat | Referenser |
|---|---|---|---|---|---|---|
| Rättegång 1 | En placebokontrollerad studie på patienter som är heterozygota för F508del-mutationen och en annan specifik mutation | Absolut förändring i ppFEV1 från baslinjen vid vecka 4 | Personer som är 12 år och äldre | • Heterozygot för F508del-mutationen och en av ~200 andra mutationer i CFTR-genen som resulterade i antingen: - Inget CFTR-protein - Ett CFTR-protein som saknar baslinjeaktivitet och inte svarar på ivacaftor och tezacaftor/ivacaftor • ppFEV1 mellan 40 % till 90 % vid screening | procentandel av förutsagd FEV1 som var 13,8 poäng högre efter 4 veckor och 14,3 poäng högre genom 24 veckor | |
| Rättegång 2 | En dubbelblind, aktivkontrollerad fas 3-studie | Absolut förändring i ppFEV1 från baslinjen vid vecka 4 | Personer som är 12 år och äldre | Homozygot för F508del-mutationen | Elexacaftor/tezacaftor/ivacaftor visade förbättringar i procent förutsagd forcerad utandningsvolym (ppFEV 1 ) jämfört med patienter som fick tezacaftor/ivacaftor | |
| Rättegång 3 | Öppen studie utan placebokontroll | Säkerhet, farmakokinetik och effekt | Barn 6–11 år | Homozygot för F508del-mutationen ELLER - Heterozygot för F508del-mutationen och en av ~200 andra mutationer i CFTR-gen som resulterade i antingen: • Inget CFTR-protein • Ett CFTR-protein som saknar baslinjeaktivitet och som inte svarar på ivacaftor och tezacaftor/ivacaftor |
säkerhets- och farmakokinetiska profiler överensstämde i allmänhet med de som observerats hos äldre patienter |
CFTR-mutationer som är känsliga för elexacaftor/tezacaftor/ivacaftor bestämdes genom en in vitro-studie av Fischer Rat Thyroid (FRT)-celler som uttryckte mutant CFTR. Elexacaftor/tezacaftor/ivacaftor visade effektivitet med mutationer där CFTR-proteinet framgångsrikt levererades till cellytan.
externa länkar
- "Elexacaftor" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Ivacaftor-kur med Tezacaftor" . Läkemedelsinformationsportal . US National Library of Medicine.