DBDMH
|
|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
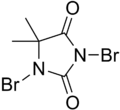
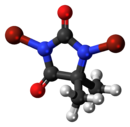
1,3-dibrom-5,5-dimetylimidazolidin-2,4-dion |
|||
| Andra namn DBDMH, Dibromantin, Dibromodimethylhydantoin
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.938 | ||
| EG-nummer |
|
||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C5H6Br2N2O2 _ _ _ _ _ _ _ _ _ | |||
| Molar massa | 285,923 g-mol -1 | ||
| Utseende | Vitt fast material | ||
| Densitet | 1,36 g/cm 3 | ||
| Smältpunkt | 197 till 203 °C (387 till 397 °F; 470 till 476 K) | ||
| 0,1 g/100 ml (20 °C) | |||
| Faror | |||
| GHS- märkning : | |||
   
|
|||
| Fara | |||
| H301 , H302 , H314 , H317 , H319 , H410 | |||
| P260 , P261 , P264 , P270 , P272 , P273 , P280 , P301+P310 , P301+P312 , P301+P330+P331, P302 +P352, P303+P 503, P303 + P 503, P303 +P 503 , P303+P 5 + P351 +P338 , P310 , P321 , P330 , P333+P313 , P337+P313 , P363 , P391 , P405 , P501 | |||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
DBDMH (även känd som 1,3-Dibromo-5,5-Dimethylhydantoin ) är en organisk förening som härrör från heterocykeln som kallas dimetylhydantoin . Denna vita kristallina förening med en lätt bromlukt används i stor utsträckning som ett desinfektionsmedel som används för rening av dricksvatten , vattenrening för rekreation, som blekmedel i massa- och pappersbruk och för behandling av industriella/kommersiella vattenkylningssystem. Dess verkan innebär inte användning av underklorsyra .
Handlingsmekanism
1,3-Dibrom-5,5-Dimetylhydantoin är en bromkälla, vilket är ekvivalent med hypobromsyra (HOBr).
- Br2X + 2 H2O → 2 HOBr + H2X
(Där H 2 X är 5,5-dimetylhydantoin)
Med ett p Ka på 8,6 dissocierar hypobromsyra delvis i vatten:
- HOBr ⇌ H + + BrO −
Hypobromsyra fungerar som en källa till "Br + ", som producerar bromidjoner i desinfektionsprocessen:
- HOBr + levande patogener → Br − + döda patogener
De resulterande bromidjonerna kan sedan genomgå oxidation till hypobromsyra i närvaro av ett oxidationsmedel med tillräcklig styrka, t.ex. ozon , underklorsyra , kaliummonopersulfat . Denna återoxidationsprocess kallas vanligtvis "aktivering" av bromidjonen:
- Br − + HOCl → HOBr + Cl −
- ^ David Ioffe, Arieh Kampf "Brom, organiska föreningar" i Kirk-Othmer Encyclopedia of Chemical Technology , 2002, av John Wiley & Sons. doi : 10.1002/0471238961.0218151325150606.a01