Cinnamycin
|
|
| Namn | |
|---|---|
|
IUPAC namn
(1 S ,4 S ,13 S ,16 S ,19 R ,22 S ,25 S ,28 R ,31 S ,37 S ,41 R ,44 R ,47 S ,50 S ,53 R ,56 R ,65 S )-44-amino-37-(2-amino-2-oxoetyl)-50-(3-amino-3-oxopropyl)-4,16,22-tribensyl-47-(3-karbamimidamidopropyl)-31-[ ( R )-karboxi(hydroxi)metyl]-41,70-dimetyl-2,5,8,14,17,20,23,26,29,32,35,38,45,48,51,54,57 ,67-oktadekaoxo-25-propan-2-yl-42,69,72-tritia-3,6,9,15,18,21,24,27,30,33,36,39,46,49,52 ,55,58,60,66-nonadekazapentacyklo[38.18.9.3 19,56 .3 28,53 .0 9,13 ]triheptakontan-65-karboxylsyra
|
|
| Andra namn Lantiopeptin; NSC-71936; Ro09-198
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Egenskaper | |
| C89H125N25O25S 3 _ _ _ _ _ _ _ _ | |
| Molar massa | 2 041,31 g ·mol -1 |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Cinnamycin är en tetracyklisk antibakteriell peptid som produceras av Streptomyces cinnamoneus och innehåller 19 aminosyrarester inklusive de ovanliga aminosyrorna treo -3-metyl-lantionin, meso - lantionin , lysinoalanin och 3-hydroxiasparaginsyra .
Cinnamycin tillhör den klass av molekyler som kallas lantibiotika och som tillhör ribosomalt syntetiserade post-translationellt modifierade peptider. Den unika receptorn för cinnamycin är fosfatidyletanolamin (PE) lipider som är en huvudförening som finns i många bakteriella cellmembran.
Cinnamycin isolerades först 1952 och några andra föreningar med liknande sekvens och struktur hittades senare.
Strukturera
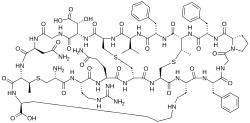
Cinnamycin har en kompakt globulär struktur och består av följande allmänna aminosyrasekvens:
- Ala-Arg-Gln-Ala-Ala-Ala-Phe-Gly-Pro-Phe-Abu-Phe-Val-Ala-Asp-Gly-Asn-Abu-Lys
Aminosyraresterna i ryggraden är sammanlänkade genom fyra bryggor inklusive en mesolantionin (Lan), två (2S , 3S ,6R )-3-metyllantioniner (MeLan) och en (2S , 8S )-lysinoalanin (LysAla)-brygga . Sidokedjetvärbindning av serin och treonin med cystein ger mesolantionin (Lan) respektive metyllantionin (MeLan). Närvaron av dessa tiolbryggor tillsammans med lisinoalaninbryggan gör cinnamycin till en av de minsta peptiderna med en välorganiserad tredimensionell struktur. Baserat på NMR- experiment består bindningsfickan av cinnamycin av 7-14 aminosyrarester som kan rymma substratet fosfatidyletanolamin (PE). Denna mindre storlek på bindningsfickan gör cinnamycin specifikt för dess receptor (PE). Emellertid är funktionen av eryto-3-hydroxi-L-asparaginsyra (HyAsp) vid rest 15 inte särskilt uttalad.
Peptiderna duramycins och ancovenin kan också anses tillhöra familjen cinnamycin. Dessa peptider består också av en liknande struktur som cinnamycin som globulära 19 aa-peptider med ett Lan, två MeLan och en ovanlig lysinoalaninbrygga mellan Lys-19 och Ser-6. De uppvisar också en modifiering i position 15, en aspartathydroxylering som ger erytro-3-hydroxi-asparaginsyran. Bland cinnamycingruppen är ancovenin den mest olika varianten eftersom den inte har aspartat 15-modifieringen och lysin-alaninbryggan.
Interaktioner mellan receptor och molekyl
Cinnamycin binder selektivt till sin receptor fosfatidyletanolamin (PE) som finns i det inre lagret av plasmamembranet med en stökiometri på 1:1. Baserat på NMR-studier har det föreslagits att denna selektivitet hos cinnamycin för PE beror på bindningen av den primära ammoniumgruppen i PE-huvudgruppen i en liten bindningsficka på peptidytan som inte kan ta emot större huvudgrupper som t.ex. t.ex. fosfatidylkolin.
Cinamycin interagerar huvudsakligen med PE genom det vätebindande nätverk som bildas mellan lipiden ammonium och ryggradens karbonyl av Phe7 och Val13. PE-ammoniumgruppen interagerar också med hydroxyl- och karboxylatgrupperna i HyAsp15. Förutom detta ammoniumbindande ställe är väten i ryggradsamiden av resterna 10−13 också kritiska för att binda lipidfosfatet.
Det har också rapporterats att duramycin och cinnamycin främjar membranbindning genom att inducera lipidrörelser i två skikt och förändra krökningen av det närvarande PE-membranet vid bindning eftersom cinnamycin företrädesvis binder till kraftigt krökta lipidmembran.
Cinnamycin-genkluster – Cin
Genetikstudierna har visat att de fyra generna cinA, cinM, cinX och cinorf7 spelar en viktig roll i biosyntesen av cinnamycin. cinA kodar för cinnamycinprekursorpeptiden. LanM-familjens proteiner som kodas av cinM-genen är ansvariga för uttorkningen av serin- och treoninrester i propeptiden följt av den efterföljande bildningen av lantioninbryggor. CinX kodar för proteinet som katalyserar hydroxyleringen av aspartat i position 15. Dessutom indikeras cinorf7 vara avgörande för bildandet av lisinoalaninbrygga.
Biosyntes
Lantibiotika är en grupp ribosomalt syntetiserade, post-translationellt modifierade antimikrobiella peptider med karakteristiska lantionin (Lan) och metyllantionin (MeLan) tioeter tvärbindningar. Biosyntesen av cinnamycin kodas av det cin biosyntetiska genklustret och syntesen initieras när den strukturella genen lanA kodar för prekursorpeptiden som bär en N-terminal förlängning som kallas "ledarpeptid" som är 59 aminosyrarester lång känns igen av olika enzymer för att bearbeta den C-terminala propetiden som är 19 aminosyrarester lång och kommer att omvandlas till cinnamycin genom posttranslationella modifieringar. Det första steget i bildandet av Lan/MeLan-bryggor är uttorkningen av serin- och treoninrester för att ge dehhydroalanin (Dha) respektive dehydrobutyirne (Dhb). Dessa genomgår intramolekylär Michael-addition med närliggande cysteinrester för att bilda tioeterbryggor. Cinnamycin tillhör klass II lantibiotika där både uttorkning och cyklisering katalyseras av ett bifunktionellt enzym som kallas LanM. Efter att kärnpeptiden har bearbetats spjälkas ledarpeptiden proteolytiskt från den mogna peptiden.
De posttranslationella modifieringarna av cinnamycin inkluderar bildandet av lantionninbryggor, bildandet av lysinoalanin (Lal)-bryggan mellan lysin 19 och serin 6 och hydroxyleringen av L-aspartat vid position 15.
I de flesta av klass II lantibiotika är GG- eller GA-proteasklyvningsmotiv närvarande medan i cinnamycin finns ett AXA-motiv mellan ledarsekvensen och kärnregionen av CinA.
Ett cinnamycinspecifikt proteas saknas i genklustret och följaktligen känns sekvensen igen av typ I-signalpeptidas från den allmänna sekretoriska ( sec )-vägen. Enzymerna som är ansvariga för Asp-hydroxylering och Lal-bryggbildning har ännu inte upptäckts.
Immunitetsmekanism
En unik immunitetsmekanism finns i den producerande stammen Streptomyces cinnamoneus mot de hämmande effekterna från den egna produkten. I allmänhet utför Cinnamycin sin antimikrobiella aktivitet genom att binda till fosfatidyletanolamin som är en viktig membranlipid i streptomyceter. För att skydda den producerande stammen kodar cinorf10-genen för ett PE-monometyltransferas som katalyserar PE-metyleringsreaktionen. Denna transkription av cinorf10 börjar vid mycket låga nivåer av cinnamycin för att säkerställa att en avsevärd mängd PE metyleras innan högnivåproduktion av cinnamycin. Baserat på strukturen av cinnamycin-PE-komplex kommer monometylerad PE inte att passa in i bindningsfickan av cinnamycin och den hämmande verkan kommer inte längre att stödjas.
Cinnamycinliknande föreningar
Baserat på klassificeringen av Jung 1991 finns det två typer av lantibiotika som typ A och typ B. Typ A lantibiotika är långsträckta, flexibla, stavliknande molekyler som är positivt laddade och verkar på bakteriella membran genom att porer bildas. Däremot har lantibiotika av typ B en oflexibel globulär struktur på grund av närvaron av karakteristisk tvärbindning mellan huvud och svans. Denna grupp av molekyler har en negativ laddning eller ingen nettoladdning och stör olika enzymer involverade i cellväggsbiosyntesen.
Cinnamycin är nära besläktat med typ B lantibiotika duramycin, duramycin B, duramycin C och ancovenin. Dessa föreningar är alla härledda från 19-aa-propeptider och har ett Lan, två MeLan och en ovanlig lysinoalaninbrygga mellan Lys-19 och Ser-6 och en erytro-3-hydroxi-L-asparaginsyra i position 15 som förmedlar interaktionen mellan cinnamycin och dess biologiska målfosfatidyletanolamin och därför viktiga för deras antimikrobiella aktivitet. De produceras alla av aktinomyceter , duramycinerna och cinnamycinen uteslutande av streptomyceter.
Biologiska aktiviteter
Förutom de antimikrobiella egenskaperna uppvisar cinnamycinliknande peptider hämmande verkan mot det angiotensinomvandlande enzymet , aktiviteten av fosfolipas A2 , proliferation av herpes simplex-virus , prostaglandin och leukotrienbiosyntes . Vidare hämmar det tillväxten av Bacillus subtilis , anaeroba bakterier, svampar och jästsvampar (men mindre intensivt).
Dessa peptider är också kapabla att behandla blodtrycksreglering, inflammation och virusinfektion. Dessa molekyler består av en väldefinierad ficka som upprättats av de fyra cykliseringshändelserna och känner igen fosfatidyletanolamin (PE) med hög affinitet och selektivitet. Denna förmåga att selektivt binda till PE-lipider gör cinnamycin till en idealisk sond för att detektera platsen för PE-innehållande membran såsom cancerceller och för att störa dem.
Föreningarna som duramycin och cinnamycin som stör PE-association med fosfatidylserinreceptorer som är nödvändiga för inträde av många höljeförsedda virus är en lovande strategi för bredspektrum antiviral aktivitet. Cinnamycin binder till substratet av fosfolipas A2 , fosfatidyletanolaminen (PE) med en hög specificitet i ett 1:1 - förhållande och denna bindning förändrar jonkanalernas funktion. Denna funktion används inom läkemedelsindustrin för behandling av cystisk fibros. Dessutom katalyserar PLA2 reaktionen för att frigöra arakidonsyra från fosfolipider i cellmembranen, vilket är en prekursor för syntesen av eikosanoider, som är förknippade med inflammation. Sådana lantibiotika kan också användas vid reglering av inflammatoriska processer. Hämningen av PLA2 är också associerad med behandlingar för vissa sjukdomar som åderförkalkning , diabetes och cancer .