Alger DNA-streckkodning
| Del av en serie om |
| DNA-streckkodning |
|---|

|
| By taxa |
| Övrig |
DNA-streckkodning av alger används ofta för artidentifiering och fylogenetiska studier. Alger bildar en fylogenetiskt heterogen grupp, vilket innebär att tillämpningen av en enda universell streckkod/ markör för artavgränsning är omöjlig, därför används olika markörer/streckkoder för detta syfte i olika alggrupper.
Kiselalger
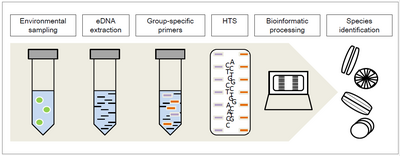
Kiselalger DNA streckkodning är en metod för taxonomisk identifiering av kiselalger även till artnivå . Den utförs med hjälp av DNA eller RNA följt av amplifiering och sekvensering av specifika, konserverade regioner i kiselalgergenomet följt av taxonomisk tilldelning .
En av de största utmaningarna med att identifiera kiselalger är att den ofta samlas in som en blandning av kiselalger från flera arter. DNA- metabarcoding är processen att identifiera den individuella arten från ett blandat prov av miljö-DNA (även kallat eDNA) som är DNA som extraherats direkt från miljön såsom i jord- eller vattenprover.
En nyligen tillämpad metod är kiselalger- DNA-metabarcoding som används för ekologisk kvalitetsbedömning av floder och vattendrag på grund av kiselalgernas specifika reaktion på speciella ekologiska förhållanden. Eftersom artidentifiering via morfologi är relativt svårt och kräver mycket tid och expertis, möjliggör high-throughput Sequencing (HTS) DNA-metabarcoding taxonomisk tilldelning och därför identifiering för det kompletta provet avseende de gruppspecifika primers som valts för den tidigare DNA- amplifieringen .
Fram till nu har flera DNA- markörer redan utvecklats, främst inriktade på 18S rRNA . Genom att använda den hypervariabla V4-regionen av den ribosomala lilla subenhetens DNA (SSU rDNA), visade sig DNA-baserad identifiering vara mer effektiv än den klassiska morfologibaserade metoden. Andra konserverade regioner i genomen som ofta används som markörgener är ribulos-1-5-bisfosfatkarboxylas (rbcL), cytokromoxidas I (cox1, COI), ITS och 28S . Det har visat sig upprepade gånger att de molekylära data som erhållits genom kiselalger eDNA-metabarcoding ganska troget återspeglar de morfologibaserade biotiska kiselalgerindexen och därför ger en liknande bedömning av ekosystemstatus. Under tiden används kiselalger rutinmässigt för bedömning av ekologisk kvalitet i andra sötvattensekosystem. Tillsammans med vattenlevande ryggradslösa djur anses de vara de bästa indikatorerna på störningar relaterade till fysiska, kemiska eller biologiska förhållanden i vattendrag. Många studier använder bentiska kiselalger för bioövervakning. Eftersom ingen idealisk kiselalger DNA-streckkod hittades, har det föreslagits att olika markörer används för olika ändamål. De mycket variabla cox1-, ITS- och 28S-generna ansågs faktiskt vara mer lämpliga för taxonomiska studier, medan mer konserverade 18S- och rbcL-gener verkar mer lämpliga för bioövervakning.
Fördelar
Att tillämpa DNA-streckkodningskonceptet på kiselalger lovar stor potential för att lösa problemet med felaktig artidentifiering och därmed underlätta analyser av den biologiska mångfalden i miljöprover.
Molekylära metoder baserade på NGS-teknologin leder nästan alltid till ett högre antal identifierade taxa vars närvaro sedan skulle kunna verifieras med ljusmikroskopi. Resultaten av denna studie ger bevis på att eDNA-streckkodning av kiselalger är lämplig för bedömning av vattenkvalitet och skulle kunna komplettera eller förbättra traditionella metoder. Stoeck et al. visade också att eDNA-streckkodning ger en mer insikt i kiselalger mångfald eller andra protistsamhällen och därför skulle kunna användas för ekologisk projektion av global mångfald. Andra studier visade andra resultat. Till exempel var inventeringar erhållna från den molekylärbaserade metoden närmare de som erhölls med den morfologibaserade metoden när rikliga arter är i fokus.
DNA-metabarcoding kan också öka den taxonomiska upplösningen och jämförbarheten över geografiska regioner, vilket ofta är svårt med endast morfologiska karaktärer. Dessutom tillåter DNA-baserad identifikation att utöka utbudet av potentiella bioindikatorer, inklusive de oansenliga taxonomiska grupperna som kan vara mycket känsliga eller toleranta för särskilda stressfaktorer. Indirekt kan de molekylära metoderna också bidra till att fylla luckorna i kunskap om artekologi, genom att öka antalet bearbetade prover tillsammans med en minskning av bearbetningstiden (kostnadseffektivitet), samt genom att öka noggrannheten och precisionen i korrelationen mellan arter /MOTUs förekomst och miljöfaktorer.
Utmaningar
För närvarande finns det ingen konsensus om metoder för DNA-konservering och isolering, val av DNA-streckkoder och PCR-primrar, eller enighet om parametrarna för MOTU-klustring och deras taxonomiska tilldelning. Provtagning och molekylära steg måste standardiseras genom utvecklingsstudier. En av de största begränsningarna är tillgången på referensstreckkoder för kiselalgerarter. Referensdatabasen för bioindikatortaxa är långt ifrån komplett trots de ständiga ansträngningarna från många nationella streckkodsinitiativ, många arter saknar fortfarande streckkodsinformation. Dessutom är de flesta befintliga metabarcoding data endast lokalt tillgängliga och geografiskt utspridda, vilket hindrar utvecklingen av globalt användbara verktyg. Visco et al. uppskattas att inte mer än 30 % av de europeiska kiselalgerarterna för närvarande finns representerade i referensdatabaser. Till exempel finns det en viktig brist på ett antal arter från de fennoskandiska samhällena (särskilt acidofila kiselalger, såsom Eunotia incisa ). Det har också visat sig att taxonomisk identifiering med DNA-streckkodning inte är korrekt över artnivån, till exempel för att särskilja sorter (referens saknas).
En annan välkänd begränsning av streckkodning för taxonomisk identifiering är klustringsmetoden som användes före den taxonomiska tilldelningen: Det leder ofta till massiv förlust av genetisk information och det enda tillförlitliga sättet att bedöma effekterna av olika klustrings- och olika taxonomiska tilldelningsprocesser skulle vara att jämföra artlistan som genereras av olika pipelines när man använder samma referensdatabas. Detta har ännu inte gjorts för de olika pipelines som används vid molekylär bedömning av kiselalgersamhällen i Europa. Taxonomiskt validerade databaser, som inkluderar tillgängliga vouchers, är också avgörande för tillförlitlig taxa-identifiering via NGS.
Dessutom visar sig primerbias ofta vara en stor källa till variation i streckkodning och PCR-primers effektivitet kan skilja sig åt mellan olika kiselalger, dvs vissa primrar leder till en preferentiell amplifiering av ett taxon framför ett annat.
Slutsatsen av överflöd från metabarcoding data anses vara en av de svåraste frågorna i miljöanvändning. Antalet genererade sekvenser av HTS motsvarar inte direkt antalet prov eller biomassa och att olika arter kan producera olika mängd avläsningar (till exempel på grund av skillnader i kloroplaststorleken med rbcL-markören). Vasselon et al. skapade nyligen en biovolymkorrigeringsfaktor vid användning av rbcL-markören. Till exempel Achnanthidium minutissimum en liten biovolym och kommer därför att generera färre kopior av rbcL-fragmentet (beläget i kloroplasten) än större arter. Denna korrektionsfaktor kräver dock omfattande kalibrering med varje arts egen biovolym och har testats endast på ett fåtal arter så långt. Fluktuationer i genkopietal för andra markörer, såsom 18S-markören, verkar inte vara artspecifika, men har inte testats ännu.
Kiselalger målregioner
Streckkodsmarkör kombinerar vanligtvis hypervariabla regioner av genomet (för att tillåta åtskillnad mellan arter) med mycket konserverad region (för att säkerställa en specificitet för målorganismen). Flera DNA-markörer, som tillhör de nukleära, mitokondriella och kloroplastgenomen ( rbcL , COI , ITS + 5.8S , SSU , 18S ...), har designats och framgångsrikt använts för identifiering av kiselalger med NGS.
18S och V4 underenhet
18S-genregionen har använts i stor utsträckning som en markör i andra protistgrupper och Jahn et al. var de första att testa 18S-genregionen för streckkodning av kiselalger. Zimmerman et al. föreslog ett 390–410 bp långt fragment av det 1800 bp långa 18S rRNA-genlokuset som streckkodsmarkör för analys av miljöprover med HTS. och diskuterar dess användning och begränsningar för identifiering av kiselalger. Detta fragment inkluderar V4-subenheten som är den största och mest komplexa av de mycket variabla regionerna inom 18S-lokuset. De betonade att denna hypervariabla region av 18S-genen har stor potential för att studera protisternas mångfald i stor skala men har begränsad effektivitet till identifiering under artnivå eller kryptiska arter.
rbcL
rbcl-genen används för taxonomistudier (Trobajo et al. 2009) vilka fördelar inkluderar att sällan någon intragenomisk variation och de är mycket lätta att anpassa och jämföra. Ett referensbibliotek med öppen tillgång, kallat R-Syst::diatom, innehåller data för två streckkoder (18S och rbcL). Det är fritt tillgängligt via en webbplats. Kermmarec et al. använde också framgångsrikt rbcL-genen för ekologisk bedömning av kiselalger. rbcL-markören kan också enkelt justeras och jämföras.
Moniz och Kaczmarska undersökte amplifieringsframgången för SSU-, COI- och ITS2-markörerna och fann att 300 – 400 bp ITS-2 + 5.8S-fragmentet gav den högsta framgångsgraden för amplifiering och god artupplösning. Denna markör användes därefter för att separera morfologiskt definierade arter med en framgångsgrad på 99,5 %. Trots denna amplifieringsframgång har Zimmerman et al. kritiserade användningen av ITS-2 på grund av intraindividuell heterogenitet. Det har föreslagits att SSU- eller rbcL-markörerna (Mann et al., 2010) är mindre heterogena mellan individer och därför mer fördelaktiga när man skiljer mellan arter.
Ansökningar
Genetiskt verktyg för bioövervakning och biobedömning
Kiselalger används rutinmässigt som en del av en uppsättning bioövervakningsverktyg som måste övervakas som en del av det europeiska ramdirektivet för vatten. Kiselalger används som en indikator på ekosystems hälsa i sötvatten eftersom de är allestädes närvarande, direkt påverkade av förändringar i fysikalisk-kemiska parametrar och visar ett bättre samband med miljövariabler än andra taxa t.ex. ryggradslösa djur, vilket ger en bättre helhetsbild av vattenkvaliteten.

eDNA-metabarcoding i biologisk bedömning av akvatiska ekosystem
Under de senaste åren har forskare utvecklat och standardiserat verktygen för metabarcoding och sekvensering av kiselalger, för att komplettera den traditionella bedömningen med mikroskopi, vilket öppnar upp en ny väg för bioövervakning för vattensystem. Att använda bentiska kiselalger genom en metod för nästa generations sekvenseringsmetod för flodbioövervakning avslöjade en god potential i det. Många studier har visat att metabarcoding och HTS (high-throughput sequencing) kan användas för att uppskatta kvalitetsstatus och mångfald i sötvatten. Som en del av miljömyndigheten har Kelly et al. har utvecklat en DNA-baserad metabarcoding-metod för att bedöma kiselalgersamhällen i floder för Storbritannien. Vasselon et al. jämförde morfologiska och HTS tillvägagångssätt för kiselalger och fann att HTS gav en tillförlitlig indikation på kvalitetsstatus för de flesta floder i termer av Specific Polluosensitivity Index (SPI). Vasselon et al. tillämpade också DNA-metabarcoding av kiselalgersamhällen på övervakningsnätverket av floder på den tropiska ön Mayotte (franska DOM-TOM).
Rimet et al. undersökte också möjligheten att använda HTS för att bedöma kiselalgerdiversitet och visade att diversitetsindex från både HTS och mikroskopisk analys var väl korrelerade men inte perfekta.
DNA-streckkodning och metabarcoding kan användas för att fastställa molekylära mått och index, som potentiellt ger slutsatser som i stort sett liknar de traditionella metoderna om ekologiska och miljömässiga status för akvatiska ekosystem.
Forensics
Kiselalger är vana vid som ett diagnosverktyg för att drunkna i rättsmedicinska metoder. Kiselalgetestet bygger på principen om inandning av kiselalger från vatten till lungorna och distribution och avsättning runt kroppen. DNA-metoder kan användas för att bekräfta om dödsorsaken verkligen var drunkning och lokalisera ursprunget till drunkning. Diatom DNA metabarcoding, ger möjlighet att snabbt analysera kiselalgergemenskapen som finns i en kropp och lokalisera ursprunget till drunkning och undersöka om en kropp kan ha flyttats från en plats till en annan.
Kryptiska arter och databasering
Kiselalger metabarcoding kan hjälpa till att avgränsa kryptiska arter som är svåra att identifiera med hjälp av mikroskopi och hjälpa till att komplettera referensdatabaser genom att jämföra morfologiska sammansättningar med metabarcoding data.
Andra mikroalger
Klorofyter har en uråldrig och taxonomiskt mycket mångsidig härstamning (Fang et al. 2014), inklusive landväxter också. Även om mer än 14 000 arter har beskrivits utifrån strukturella och ultrastrukturella kriterier (Hall et al. 2010) är deras morfologiska identifiering ofta begränsad.
Flera streckkoder för klorofyter har föreslagits för DNA-baserad identifiering för att kringgå problematiken med den morfologiska. Även om den kodande genen för cytokromoxidas I (COI, COX) (länk) är en standardstreckkod för djur, visade den sig vara otillfredsställande för klorofyter eftersom genen innehåller flera introner i denna alggrupp (Turmel et al. 2002). Nukleära markörgener har använts för klorofyter är SSU rDNA, LSU rDNA, rDNA ITS (Leliaert et al. 2014).
Makroalger
Makroalger - en morfologisk snarare än taxonomisk grupp - kan vara mycket utmanande att identifiera på grund av deras enkla morfologi, fenotypiska plasticitet och alternativa livscykelstadier. Således har algsystematik och identifiering kommit att förlita sig mycket på genetiska/molekylära verktyg som DNA-streckkodning . SSU rDNA -genen är en vanlig streckkod för fylogenetiska studier på makroalger. SSU rDNA är emellertid en mycket konserverad region och saknar vanligtvis upplösning för artidentifiering.
Under de senaste två decennierna har vissa standarder för DNA-streckkodning i syfte att artidentifiera utvecklats för var och en av huvudgrupperna av makroalger. Cytokrom c oxidas subenhet I (COI) genen används vanligtvis som streckkod för röda och bruna alger, medan tufA (plastid elongation factor), rbcL (rubisco large subunit) och ITS (intern transcribe spacer ) vanligtvis används för grönalger. Dessa streckkoder är vanligtvis 600-700 bp långa.
Streckkoderna skiljer sig vanligtvis mellan de tre huvudgrupperna av makroalger (röda, gröna och bruna) eftersom deras evolutionära arv är mycket varierande. Makroalger är en polyfyletisk grupp, vilket innebär att de inom gruppen inte alla delar en nyligen gemensam förfader, vilket gör det svårt att hitta en gen som är bevarad bland alla utom tillräckligt varierande för artidentifiering.
Målregioner
| Taxonomisk grupp | Markörgen | ||
| kärn | mitokondriella | kloroplastid | |
| Klorofyter | SSU rDNA, LSU rDNA, rDNA ITS | tuf A, rbc L | |
| Rhodofyter | Fykoerytrin, förlängningsfaktor, LSU rDNA | cox 1, cox 2-3 spacer | rbc L, Rubisco spacer |
| Feofyter | RDNA ITS | cox 1, cox 3 | psb A, rbc L, Rubisco spacer |
| Krysofyter och synurofyter | SSU rDNA, rDNA ITS | cox 1 | psa A, rbc L |
| Kryptofyter | SSU rDNA, LSU rDNA, rDNA ITS | cox 1 | Rubisco distans |
| Bacillariofyter | SSU rDNA, LSU rDNA, rDNA ITS | cox 1 | rbc L |
| Dinofyter | LSU rDNA, rDNA ITS | cox 1, cob | PsbA ncr , 23S rDNA |
| Haptofyter | SSU rDNA, LSU rDNA, rDNA, rDNA ITS | cox 1b- atp 4 | tuf A |
| Raphidophytes | SSU rDNA, LSU rDNA, rDNA, rDNA ITS | cox 1 | psa A , rbc L |
| Xantofyter | RDNA ITS | Rbc L, psb A- rbc L spacer | |
| Klorarachniofyter | Nukleärt rDNA ITS, nukleomorft rDNA ITS | ||
| Euglenophytes | SSU rDNA, LSU rDNA | SSU rDNA, LSU rDNA | |
Anpassad från
Se även
Detaljerad information om DNA-streckkodning av olika organismer finns här: