Alfa-Haloketon

Inom organisk kemi är en a - haloketon en funktionell grupp som består av en ketongrupp eller mer allmänt en karbonylgrupp med en a- halogensubstituent . a-haloketoner är alkyleringsmedel . Framträdande a-haloketoner inkluderar fenacylbromid och kloraceton .
Strukturera
Den allmänna strukturen är RR'C(X)C(=O)R där R är en alkyl- eller arylrest och X någon av halogenerna. Den föredragna konformationen för en haloketon är den för en cisoid med halogenen och karbonylen som delar samma plan eftersom det steriska hindret med karbonylalkylgruppen i allmänhet är större.
Haloketonsyntes
Haloketoner och halokarbonylföreningar syntetiseras i allmänhet genom reaktion av karbonylföreningar med källor för X + (X = halogen), som tillhandahålls med halogener :
- RC(O)CH3 + X2 → RC(O)CH2X + HX
Specialiserade källor för elektrofila halogeneringsmedel inkluderar N -bromsuccinimid och 1,3-dibrom-5,5-dimetylhydantoin (DBDMH). I Nierenstein-reaktionen reagerar en acylklorid med diazometan
Asymmetrisk syntes
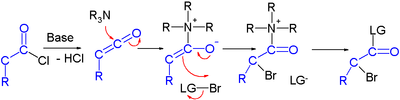
Ansträngningar rapporteras i asymmetrisk syntes av halokarbonyler genom organokatalys . I en studie omvandlas en syraklorid till en α-halo-ester med en stark bas ( natriumhydrid ), en bromdonator och en organokatalysator baserad på prolin och kinin :
I den föreslagna reaktionsmekanismen omvandlar basen först syrakloriden till ketenen , organokatalysatorn introducerar sedan kiralitet genom sin kinonoida tertiära amin och bildar en ketenaddukt.
Reaktioner
Haloketoner deltar i flera reaktionstyper, särskilt eftersom de är bifunktionella, med två elektrofila ställen (alfakol och karbonylkol). I en manifestation av denna dualitet är de föregångare till heterocykler. Aminotiazoler framställs genom reaktion av kloroketoner med tiourea och med tioamider. Pyrroler genom reaktion av haloketoner med dikarbonyler och ammoniak Hantzsch-pyrrolsyntesen .
Illustrativa för deras alkylerande aktivitet är reaktioner med kaliumjodid i aceton , kloraceton reagerar snabbare än 1-klorpropan med en faktor på 36 000. Haloketoner reagerar med fosfiter i Perkow-reaktionen .
På grund av närvaron av två elektrondragande grupper (karbonyl och halogenid), är alfa-CH-centret surt. Denna egenskap utnyttjas i Favorskii-omarrangemanget , där basen först abstraherar en sur α-proton och den resulterande karbanjonen sedan tränger undan halogenen.
I korsade aldolreaktioner mellan haloketoner och aldehyder är den initiala reaktionsprodukten en halohydrin som sedan kan bilda en oxiran i närvaro av bas.
Halogruppen kan tas bort vid reduktiv dehalogenering av haloketoner . Alfa-haloketoner kan också omvandlas till alkener genom behandling med hydrazin.
Som en keton kan en a-haloketon reagera med aminer för att bilda en a-haloimin, som kan omvandlas tillbaka till moderhaloketonen genom hydrolys , så att haloiminer kan användas som maskerade versioner av haloketoner. Detta gör att vissa kemiska omvandlingar kan uppnås som inte är möjliga direkt på moderhaloketonerna.