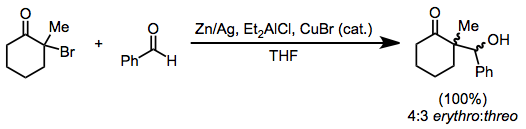Reduktiv dehalogenering av haloketoner
Inom organisk kemi kan α - haloketoner reduceras med förlust av halogenatomen för att bilda enolater . α-haloketonerna framställs lätt från ketoner genom olika ketonhalogeneringsreaktioner , och produkterna är reaktiva mellanprodukter som kan användas för en mängd andra kemiska reaktioner .
Introduktion
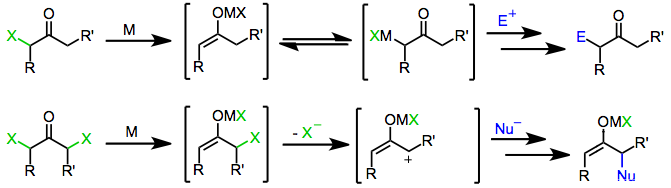
Reduktionen av a-haloketoner genererar en mängd olika produktstrukturer som kan uppvisa unika substitutionsmönster och reaktivitet. Till exempel leder reduktion av α,α'-dihalogenketoner till 2-oxyallylmetallkomplex, som deltar i [4+3] och [3+2] cykloadditionsreaktioner som 2π-komponenten. 2-Oxyallyl-metallmellanprodukter kan också fånga upp nukleofiler i en process som involverar ompolering av a-kolet. Dessutom, eftersom reduktion av monohaloketoner producerar enolater på ett platsspecifikt sätt, kan reaktioner associerade med enolater ( alkylering , aldol , Michael ) utföras med användning av haloketonsubstrat under reduktiva betingelser.
(1)
Mekanism
Många reduktionsmedel som används i denna typ av reaktion är kommersiellt tillgängliga. Ett fåtal kräver förberedelse och omedelbar användning, inklusive zink-kopparpar och zink/silverpar. och organokuprater
Monohalo ketoner
Monohaloketoner reduceras av både en-elektron- och två-elektron-reducerande medel för att ge moderketonerna, derivat funktionaliserade med elektrofiler eller dimeriseringsprodukter . Själva reduktionsmekanismen beror på reduktionsmedlets natur.
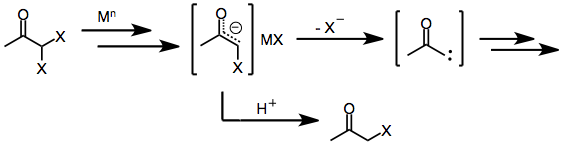
En-elektronreducerande medel, såsom d 6 eller d 1 övergångsmetallkomplex , donerar initialt en enstaka elektron till haloketonen. Fragmentering av den resulterande radikalanjonen ger en organisk radikal och halidanjon. Donation av en andra elektron från en andra ekvivalent av reduktionsmedel leder till bildningen av ett metallenolat i vilket oxidationstillståndet för reduktionsmedlet har ökat med en.
(2)
Tvåelektronreducerande medel, av vilka den mest framträdande är zinkmetall , genomgår direkt oxidativ tillsats till monohalogenketoner för att ge metallenolater i vilka metallens oxidationstillstånd har ökat med två. Efterföljande disproportionering med oreagerad haloketon leder ibland till bildningen av två ekvivalenter enolradikal, som därefter kan dimeriseras.
(3)
Behandling av enolater härledda från antingen en- eller två-elektronreducerande medel med en elektrofil ger a-funktionaliserade ketoner som slutprodukt.
a,a-Dihalo-ketoner
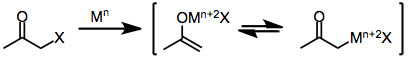
I likhet med monohaloketoner bildar geminala dihaloketoner initialt metallenolater vid exponering för en- eller tvåelektronreducerande medel. I närvaro av ett protiskt lösningsmedel upphör reduktionen i detta skede för att ge monohaloketonen (som kan reduceras ytterligare till moderketonen). I frånvaro av en infångande elektrofil eller protiskt lösningsmedel ger emellertid förlust av den återstående haliden från enolatmellanprodukten a-ketokarbener eller karbenoider, som genomgår CH-insättningsreaktioner.
(4)
a,a'-Dihalo-ketoner
Initial reduktion av a,a'-dihalogenketoner leder till metallenolatmellanprodukter. Förlust av den återstående haliden genererar 2-oxiallylmetallkomplex, som genomgår [4+3] och [3+2] cykloadditionsreaktioner i närvaro av diener eller olefiner. Isomerisering av 2-oxiallylmetallkomplex till cyklopropanon- och allenoxidformer är snabb och reversibel; ökning av den kovalenta karaktären hos syre-metallbindningen gynnar 2-oxyallylisomeren.
(5)
Omfattning och begränsningar
Reduktioner av a-haloketoner kan ge moderketonerna, partiellt reducerade halogenketoner eller produkter som härrör från avlyssning av intermediärer längs reduktionsvägen med nukleofiler eller elektrofiler. De erhållna produkterna beror på både reduktionsmedlet och substitutionsmönstret för haloketonen.
Monohalo ketoner
Monohaloketoner kan reduceras till motsvarande moderketon med litiummetall , följt av protonering av enolatet. Andra användbara reduktionsmedel för denna omvandling inkluderar litiumdialkylkuprater och molybdenhexakarbonyl-aluminiumoxid.
(6)
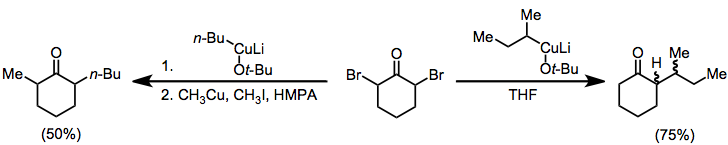
Alkylering av enolater som genereras genom reduktion av monohaloketoner är begränsad till de mest reaktiva alkylhalogeniderna . Reduktion av närvaron av en aldehyd leder emellertid till reduktiva aldolprodukter, analogt med Reformatsky-reaktionen av haloester. Zinkdamm kan användas ensamt; eller som amalgam , i kombination med dietylaluminiumklorid , eller med katalytiska mängder koppar(I)bromid .
(7)
Reduktiv dimerisering kan resultera från kombinationen av två mellanliggande a-acylradikaler eller nukleofil attack av ett metallenolat på oreagerad haloketon. Även om komplexa reaktionsblandningar ofta resulterar, är selektiv dimerisering möjlig i vissa fall. I exemplet nedan är produktdistributionen lösningsmedelsberoende
(8)
a,a-Dihalo-ketoner
Beroende på de betingelser som används kan geminala dihaloketoner reduceras till moderketonen, monohaloketonen eller funktionaliserad monohaloketon med organokuprater . Uppvärmning av funktionaliserade α-haloketoner producerade under dessa förhållanden från -40 °C till rumstemperatur leder till motsvarande α,β-omättade keton.
(9)
a,a'-Dihalo-ketoner
Organokuprater kan också användas för reduktion av a,a'-dihalogenketoner till alkylerade ketoner. I frånvaro av en elektrofil isoleras monoalkylketonen i gott utbyte; när en alkyljodid tillsätts, isoleras dialkylketonen (geminal alkylering är en problematisk bireaktion).
(10)
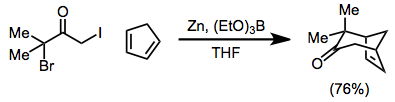
De 2-oxyallylmetallmellanprodukter som genereras under reduktioner av a,α'-dihalogenketoner med järn(0)-komplex deltar i [4+3] och [3+2] cykloadditionsreaktioner för att bilda cykloheptenoner respektive cyklopentanoner. Under [3+2] cykloadditionsreaktioner kan substituenten på alkenen elimineras för att tillhandahålla cyklopentenoner från alkener i en behållare.
(11)
Omfattningen av [4+3] cykloadditioner är bred - reaktionen kan användas för att bilda cykloheptenoner, såväl som bryggade eller sammansmälta polycykliska produkter. Reduktion kan utföras i närvaro av 4π-komponenten
(12)
Syntetiska applikationer
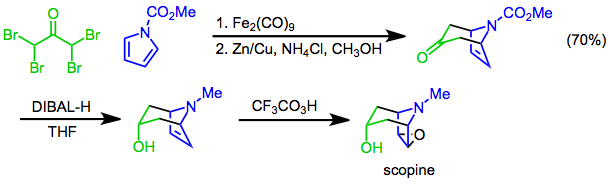
[4+3] cykloadditioner av pyrroler kan användas för att fastställa det bicykliska skelettet av tropanalkaloider . Till exempel använder en syntes av skopin [4+3]-cykloadditionen av N -metoxikarbonylpyrrol och α,α,α',α'-tetrabromaceton som ett nyckelsteg. Diastereoselektiv reduktion med diisobutylaluminiumhydrid (DIBAL-H) följt av epoxidering med trifluorperättiksyra ger målet.
(13)