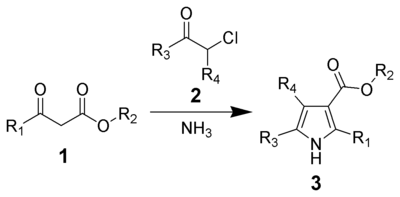
Hantzsch pyrrolsyntes
Hantzsch- pyrrolsyntesen , uppkallad efter Arthur Rudolf Hantzsch , är den kemiska reaktionen mellan β-ketoestrar ( 1 ) med ammoniak (eller primära aminer ) och α-haloketoner ( 2 ) för att ge substituerade pyrroler ( 3 ). Pyrroler finns i en mängd olika naturliga produkter med biologisk aktivitet, så syntesen av substituerade pyrroler har viktiga tillämpningar inom medicinsk kemi. Alternativa metoder för att syntetisera pyrroler finns, såsom Knorr Pyrrole Synthesis och Paal-Knorr Synthesis .
Mekanism
Nedan är en publicerad mekanism för reaktionen:
Mekanismen börjar med att aminen ( 1 ) angriper β-kolet i β-ketoestrarna ( 2 ), och så småningom bildar en enamin ( 3 ). Enaminen angriper sedan karbonylkolet i a-haloketonen ( 4 ). Detta följs av förlusten av H 2 O, vilket ger en imin ( 5 ). Denna intermediär genomgår en intramolekylär nukleofil attack och bildar en 5-ledad ring ( 6 ). Slutligen elimineras ett väte och pi-bindningarna omarrangeras i ringen, vilket ger slutprodukten ( 7 ).
En alternativ mekanism har föreslagits där enaminen ( 3 ) angriper a-kolet i a-haloketonen ( 4 ) som en del av en nukleofil substitution, istället för att attackera karbonylkolet.
Generaliserad reaktion under mekanokemiska förhållanden
En generalisering av Hantzsch-pyrrolsyntesen utvecklades av Estevez, et al. I denna reaktion kan högsubstituerade pyrroler syntetiseras i en enkärlsreaktion, med relativt höga utbyten (60% - 97%). Denna reaktion involverar höghastighetsvibrationsmalning (HSVM) av ketoner med N -jodosuccinimid (NIS) och p -toluensulfonsyra , för att bilda en a-jodoketon in situ . Detta följs av tillsats av en primär amin, en β-dikarbonylförening, cerium(IV) ammoniumnitrat (CAN) och silvernitrat , som visas i schemat nedan:
Ansökningar
2,3-dikarbonylerade pyrroler
2,3-dikarbonylerade pyrroler kan syntetiseras med en version av Hantzsch Pyrrole Synthesis. Dessa pyrroler är särskilt användbara för total syntes eftersom karbonylgrupperna kan omvandlas till en mängd andra funktionella grupper.
Substituerade indoler
Reaktionen kan också ske mellan en enamin och en a-haloketon för att syntetisera substituerade indoler , som också har biologisk betydelse.
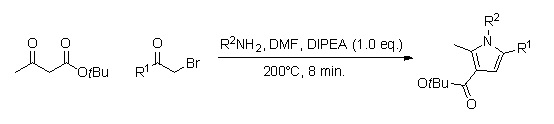
Kontinuerligt flödeskemi
Ett bibliotek av substituerade pyrrolanaloger kan snabbt produceras genom att använda kontinuerligt flödeskemi (reaktionstider på cirka 8 min.). Fördelen med att använda denna metod, i motsats till syntesen i kolven, är att denna inte kräver upparbetning och rening av flera mellanprodukter, och kan därför leda till ett högre procentuellt utbyte.