Ube3a-ATS
| SNHG14- | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , 115HG, LNCAT, NCRNA00214, UBE3A-AS, UBE3A-AS1, UBE3AATS, liten nukleolär RNA-värdgen 14, IC-SNURF-SNRPN, U-UBE3A-ATS, UBE3A-ATS, Ube3a-IDs, Ube3a- | |||||||||||||||||||||||||||||||||||||||||||||||
| IDs | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
UBE3A-ATS/Ube3a-ATS (människa/mus), annars känd som ubiquitinligas E3A-ATS, är namnet på antisens-DNA-strängen som transkriberas som en del av ett större transkript som kallas LNCAT (stort icke-kodande antisens-transkript) vid Ube3a - stället. Ube3a - lokuset är inpräntat och i centrala nervsystemet uttrycks endast från moderns allel. Tystnad av Ube3a på den paternala allelen tros ske genom Ube3a-ATS- delen av LNCAT , eftersom icke-kodande antisense-transkript ofta finns på präglade loci. Deleteringen och/eller mutationen av Ube3a på moderns kromosom orsakar Angelmans syndrom (AS) och Ube3a-ATS kan visa sig vara en viktig aspekt för att hitta en terapi för denna sjukdom. Medan hos patienter med AS den moderliga Ube3a -allelen är inaktiv, är den paternala allelen intakt men epigenetiskt tystad. Om den inte tystas kan den paternala allelen vara en källa till aktivt Ube3a-protein hos AS-patienter. Därför kan en förståelse för mekanismerna för hur Ube3a-ATS kan vara involverad i att tysta den faderliga Ube3a leda till nya terapier för AS. Denna möjlighet har visats av en nyligen genomförd studie där läkemedlet topotecan , administrerat till möss som lider av AS, aktiverade uttrycket av den paternala Ube3a -genen genom att sänka transkriptionen av Ube3a-ATS .
LNCAT -organisation
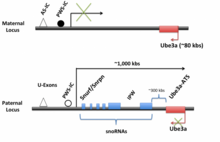
Human UBE3A-ATS uttrycks som en del av LNCAT huvudsakligen från den paternala allelen i det centrala nervsystemet ( CNS). Transkriptet är cirka 450 kbs långt, börjar vid U-exonerna och sträcker sig så långt som till UBE3A på den motsatta strängen, möjligen bortom. Promotorn för Snurf / Snrpn och imprinting-centret finns i U-exon-regionen . Promotorregionen är absolut nödvändig, eftersom borttagning av detta område avskaffar Ube3a-ATS- transkription . Nära promotorn finns PWS-IC och ca 35 kbs uppströms om PWS-IC är AS-IC. Dessa två regioner tros kontrollera uttrycket av hela LNCAT -strängen. Med utgångspunkt från promotorn kan hela transkriptet transkriberas och efter transkription bearbetas och splitsas ytterligare. Recenserad i Trends in Neurosci .
Beläget bredvid U-exon-promotorregionen är Snrpn/Snurf som alternativt kan splitsas till antingen Snrpn eller Snurf hos människor (i möss förblir detta som ett bicistroniskt transkript). Snrpn kodar för ett protein med okänd funktion som lokaliseras till cellkärnan . Snurf kodar för ett litet nukleärt ribonukleoprotein . Även om de flesta av dessa proteiner är involverade i splitsning , är rollen för detta specifika protein ännu inte känd. Nedströms från Snrpn/Snurf och inom dess introner finns sekvenser för flera C/D box snoRNA . De flesta C/D-box-snoRNA fungerar i icke- mRNA- metylering . Men nyligen har ett snoRNA på Ube3a-ATS , SNORD 115, visat sig ändra den alternativa splitsningen av serotoninreceptorn 2C pre-mRNA. Dessutom har detta snoRNA förmågan att ändra splitsningen av fem olika mRNA. Bland sekvenserna för snoRNA:erna finns kapslad IPW (märkt Prader-Willi), en icke-kodande region vars deletion tros orsaka Prader-Willis syndrom .
Modellsystem
Musen och människan Ube3a-ATS/Ube3a är ortologa och regionernas allmänna organisationer liknar varandra. Till exempel innehåller muslokuset också Snurf/Snrpn , snoRNA och IPW. De största skillnaderna är placeringen och längden på Ube3a-ATS- transkripten. Den mänskliga Ube3a/Ube3a-ATS är belägen på kromosom 15 , medan musen Ube3a är belägen på kromosom 7. Mus- LNCAT , inklusive Ube3a-ATS , är cirka 1000 kb lång, mycket längre än den mänskliga 450 kb LNCAT . På grund av den liknande organisationen av musen och människans LNCAT/Ube3a-ATS och det faktum att musens Ube3a- lokus också är inpräntat , är musen ett utmärkt modellsystem för att studera imprinting och interaktionerna mellan Ube3a/Ube3a-ATs . Dessutom fortsätter musneuroner att behålla sitt präglingsmönster i kulturen.
Skarvvarianter och placeringar
Medan hela LNCAT -transkriptet, inklusive Ube3a-ATS -transkriptet kan transkriberas, skarvas det ofta för att inkludera och utesluta en mängd olika exoner. Olika skarvvarianter uttrycks i olika vävnadstyper och situationer. För det mesta tror man att åtminstone någon typ av Ube3a-ATS uttrycks i CNS-celler som är präglade, såsom Purkinje-celler och hippocampusneuroner . Det finns emellertid spatiotemporal reglering av både nedströms- och uppströmsdelen av detta transkript. och Journal of Neuroscience .
I musembryon detekterades Snurf/Snrpn -exoner i blastocyster cirka 7 dagar efter coitem och fortsatte att uttryckas under hela utvecklingen. Snurf /Snrpn -exonerna är begränsade till CNS-vävnad under utveckling och uttrycks först senare under vuxen ålder i annan vävnad. Ube3a-ATS- exoner upptäcktes inte förrän 10 dagar efter coitem och deras uttryck var också begränsat till CNS under utveckling. I allmänhet detekteras Ube3a-ATS under de inledande stadierna av neurogenes medan Snurf/Snrpn uttrycks i odifferentierade prekursorceller och under hela differentieringsförloppet. Det finns minst 10 olika splitsningsisoformer enligt UCSC-genomläsaren.
Enligt en studie finns splitsningsvarianten som direkt överlappar Ube3a i cytoplasman.
Förhindrar uttryck på båda allelerna
Ett specifikt imprinting center-kluster ansågs kontrollera det differentiella uttrycket av Ube3a-ATS på moderns och faderns alleler . Det finns två regioner i imprinting centers (ICs) som finns förknippade med AS och PWS - AS-IC och PWS-IC. Dessa präglingscentra är kontrollregioner som bestämmer om omgivande gener och regioner kan uttryckas och finns på både moderns och faderns alleler. Medan differentiella metyleringsmönster på moderns och faderns gener ofta är associerade med prägling, förblir AS-IC ometylerad vid båda allelerna. Emellertid är den angränsande PWS-IC metylerad på moderallelen, men förblir ometylerad på den paternala allelen.
PWS-IC är misstänkt för att kontrollera uttrycket av LNCAT och Ube3a-ATS . Hos möss där PWS-IC har raderats minskar uttrycket av Ube3a-ATS . I det centrala neurala systemet uttrycks Ube3a-ATS företrädesvis från den paternala allelen där PWS-IC inte är metylerad. Å andra sidan, på den maternala allelen, där PWS-IC är metylerad, uttrycks inte Ube3a-ATS , vilket tyder på att metyleringen av PWS-IC på något sätt förhindrar Ube3a-ATS- uttryck. Detta stöds av flera studier där förhindrande av metylering av PWS-IC genom att slå ut metyltransferaser i embryonala stamceller resulterar i biallelisk expression av Ube3a-ATS och tystnad av Ube3a på moderns allel.
Men metylering är inte den enda processen som är involverad i att förhindra uttrycket av moderns Ube3a-ATS . Det förväntas att präglingsdomänerna interagerar med andra proteiner, vilket bidrar till att tysta LNCAT och Ube3a-ATS på moderns allel . Till exempel, när MECP2 slås ut, som hos patienter med Retts syndrom , uttrycks Ube3a-ATS bialleliskt, vilket minskar uttrycket av Ube3a från moderns allel.
Kollisionsmodell
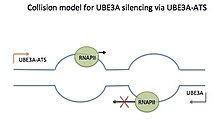
Det finns för närvarande tre modeller som förklarar hur Ube3a-ATS av LNCAT tystar den faderliga Ube3a - kollisionsmodellen, RNA-DNA-interaktionsmodellen och den dubbelsträngade RNA- interferensmodellen. Även om dessa modeller inte har demonstrerats direkt för Ube3a/Ube3a-ATS anses de vara rimliga baserat på bevis för tystnad av andra naturliga antisens-transkript med dessa metoder. Kollisionsmodellen, på grund av de senaste stödjande studierna, verkar dock mest trolig.
Kollisionsmodellen kan ses som en väg bred nog för endast en bil. En smart bil färdas från ena hållet och en plog från andra hållet, och så småningom kolliderar. Efter kollisionen skjuter plogen den smarta bilen bakåt, medan den fortsätter att färdas framåt. I kollisionsmodellen för Ube3a/Ube3a-ATS färdas RNA-polymeraser (RNAP) mot varandra längs sens- och antisensmallarna under transkription . Sens- och antisensmallarna överlappar för Ube3a och Ube3a-ATS . De två transkriptionsbubblorna kommer att kollidera frontalt, och RNAP som transkriberar Ube3a-ATS , som är plogen, kommer att trycka RNAP som transkriberar Ube3a (smart bil), bakåt och så småningom bort från mallen. Detta förhindrar fullständig transkription av Ube3a.
Stödet för denna modell kommer från två färska studier. Den första studien tittade på transkription av gener på senssträngar som överlappades av gener som uttrycks på antisenssträngen . Ju längre överlappningsområdet var, desto mindre effektiv var transkriptionen av sense-strängen, vilket indikerar att transkription på en sträng interfererar med transkriptionen på den andra strängen. En annan studie övervakade direkt kollisioner mellan RNAP:er som transkriberar en mall med hjälp av atomkraftsmikroskopi. RNAP stoppades på DNA-fragment och kolliderade med andra förlängande RNAP. Bilderna visade stopp av de två RNAP:erna omedelbart efter kollisionen, förutom att en av RNAP:erna gick tillbaka.
Även om dessa studier inte har utförts för Ube3a/Ube3a-ATS , kan användningen av atomkraftsmikroskopi för att övervaka transkription på detta lokus ge insikt om hur Ube3a faktiskt tystas via Ube3a-ATS . Ytterligare studier är fortfarande mycket nödvändiga för att bekräfta dessa modeller för Ube3a . [ citat behövs ]
Motsägelsefulla studier
Medan flera studier stödjer tanken att Ube3a-ATS kan vara inblandad i faderlig Ube3a- tystnad, motsäger andra studier detta. Särskilt en studie argumenterar mot att Ube3a tystas i cis av Ube3a-ATS . I denna studie, när moderns Ube3a- allel raderades, sågs en ökning av faderns Ube3a-ATS- uttryck. Detta tyder på att i stället för att paternal Ube3a-ATS kontrollerar paternal Ube3a , så undertrycker moderns Ube3a på något sätt uttrycket av paternans Ube3a-ATs , möjligen i trans snarare än i cis . En växelverkan mellan de maternala och paternala homologa regionerna av dessa gener observerades i själva verket i mänskliga och musceller under interfas.
En mekanism att förklara i trans- tystnad inkluderar en interaktion mellan faderns Ube3a-ATS- RNA och moderns Ube3a - mRNA . Det är möjligt att moderns Ube3a- mRNA interagerar med faderns Ube3a-ATS- RNA och minskar stabiliteten för båda dessa transkript. När endast Ube3a-ATS görs utan Ube3a blir Ube3a-ATS mer stabil .
En annan studie har föreslagit att Ube3a-ATS- uttryck inte förekommer i präglade regioner. In situ- hybridiseringar avslöjade inte Ube3a-ATS i Purkinje-celler eller hippocampala neuroner. Emellertid uttrycktes andra exoner uppströms som motsvarar Snurf / Snrpn , vilket tyder på att kollisionsmodellen fortfarande kan förekomma. Därför krävs ytterligare forskning.
Framtiden
Flera studier har försökt utnyttja möjligheten att kontrollera Ube3a- uttryck genom Ube3a-ATS . I AS är den faderliga PWS-IC inte metylerad, vilket förmodligen tillåter Ube3a-ATS- uttryck. Därför, om metylering av PWS-IC var möjlig, Ube3a-ATS- transkription kunna förbjudas, vilket tillåter Ube3a -uttryck från den paternala allelen att kompensera för bristen på uttryck från den moderna allelen. En ettårig studie utfördes med flera AS-patienter. Dessa patienter sattes på metyleringsfrämjande dieter som bestod av betain , metafolin , kreatin och vitamin B12- tillskott. Efter ett år förändrades dock inte metyleringsmönstren hos dessa patienter.
En annan studie testade ett stort bibliotek av olika läkemedel och identifierade flera topoisomeras I- och II- hämmare som ökade uttrycket av paternal Ube3a i musneuroner och möss. Topoisomerasinhibitorer används i stor utsträckning som kemoterapeutika och gör att replikerande celler genomgår apoptos genom att inducera dubbelsträngsbrott som stoppar replikationsgaffeln . Deras verkningsmekanism för att aktivera det paternala Ube3a är dock ännu inte känd, men kan innebära transkriptionsinterferens med Ube3a-ATS , eftersom Ube3a-ATS- transkripten minskade efter läkemedelsbehandling. Gruppen valde specifikt att studera topotekan , som var det mest effektiva i ett lågt nanomolärt intervall och som redan är godkänt av Food and Drug Administration för behandling av flera typer av cancer.