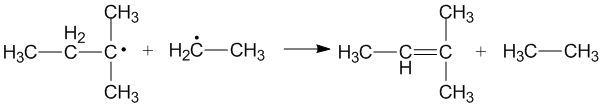Radikal disproportionering
Radikal disproportionering omfattar en grupp reaktioner inom organisk kemi där två radikaler reagerar och bildar två olika icke-radikala produkter. Radikaler i kemi definieras som reaktiva atomer eller molekyler som innehåller en oparad elektron eller elektroner i ett öppet skal. De oparade elektronerna kan göra att radikaler blir instabila och reaktiva. Reaktioner i radikal kemi kan generera både radikala och icke-radikala produkter . Radikala disproportioneringsreaktioner kan uppstå med många radikaler i lösning och i gasfas . På grund av radikalmolekylernas reaktiva natur fortskrider disproportionering snabbt och kräver liten eller ingen aktiveringsenergi . De mest grundligt studerade radikaldisproportioneringsreaktionerna har utförts med alkylradikaler , men det finns många organiska molekyler som kan uppvisa mer komplexa disproportioneringsreaktioner i flera steg.
Mekanism för radikal disproportionering
I radikala disproportioneringsreaktioner fungerar en molekyl som en acceptor medan den andra molekylen fungerar som en donator. I de vanligaste disproportioneringsreaktionerna tas en väteatom eller abstraheras av acceptorn när donatormolekylen genomgår en elimineringsreaktion för att bilda en dubbelbindning . Andra atomer såsom halogener kan också abstraheras under en disproportioneringsreaktion. Abstraktion uppstår som en head to tail-reaktion med den atom som abstraheras vänd mot den radikala atomen på den andra molekylen.
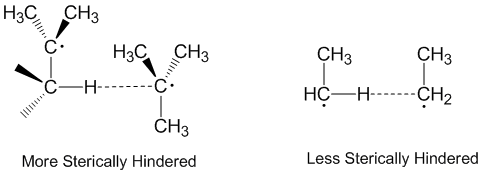
Disproportionering och steriska effekter
Radikal disproportionering anses ofta ske på ett linjärt sätt där givarradikalen, acceptorradikalen och atomen accepteras längs samma axel. Faktum är att de flesta disproportioneringsreaktioner inte kräver linjär orientering i rymden. Molekyler som är mer steriskt hindrade kräver arrangemang som är mer linjära och reagerar därmed långsammare. Steriska effekter spelar en betydande roll vid disproportionering med etylradikaler som fungerar som mer effektiva acceptorer än tert-butylradikaler . Tert-butylradikaler har många väten på intilliggande kol att donera och steriska effekter hindrar ofta tert-butylradikaler från att komma nära att abstrahera väte.
Alkylradikal disproportionering
Disproportionering av alkylradikal har studerats omfattande i vetenskaplig litteratur. Under disproportionering av alkylradikal är en alkan och en alken slutprodukterna och bindningsordningen för produkterna ökar med en över reaktanterna. Således är reaktionen exoterm (ΔH = 50 – 95 kcal/mol) och fortskrider snabbt.
Korsdisproportionering av alkylradikaler
Korsdisproportionering uppstår när två olika alkylradikaler blir oproportionerliga för att bilda två nya produkter. Olika produkter kan bildas beroende på vilken alkylradikal som fungerar som donator och vilken som fungerar som acceptor. Effektiviteten hos primära och sekundära alkylradikaler som donatorer beror på de steriska effekterna och konfigurationen av radikalacceptorerna.
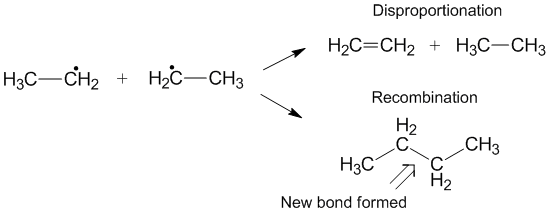
Konkurrens med rekombination
En annan reaktion som ibland kan uppstå istället för disproportionering är rekombination. Under rekombination bildar två radikaler en ny icke-radikal produkt och en ny bindning. I likhet med disproportionering är rekombinationsreaktionen exoterm och kräver liten eller ingen aktiveringsenergi. Förhållandet mellan hastigheterna för disproportionering och rekombination hänvisas till som kD / kC och gynnar ofta rekombination jämfört med disproportionering för alkylradikaler. När antalet överförbara väten ökar, hastighetskonstanten för disproportionering i förhållande till hastighetskonstanten för rekombination.
Kinetisk isotopeffekt på disproportionering och rekombination
När väteatomerna i en alkylradikal ersätts med deuterium , fortskrider disproportionering med en något långsammare hastighet medan rekombinationshastigheten förblir densamma. Således påverkas disproportionering svagt av den kinetiska isotopeffekten med k H /k D = 1,20 ± 0,15 för eten. Väte och deuteroner är inte involverade i rekombinationsreaktioner. Emellertid sker deuteronabstraktion under disproportionering långsammare än väteabstraktion på grund av den ökade massan och minskade vibrationsenergin hos deuterium, även om den experimentellt observerade k H /k D är nära ett .
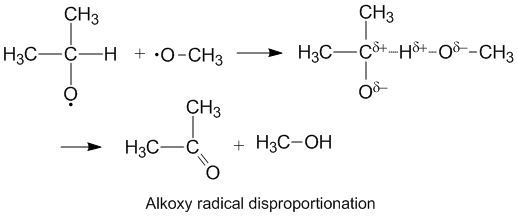
Polära effekter och disproportionering av alkoxiradikal
Alkoxiradikaler som innehåller oparade elektroner på en syreatom uppvisar en högre kD / kC jämfört med alkylradikaler. Syret har en partiell negativ laddning som tar bort elektrontätheten från donatorns kolatom och därigenom underlättar väteabstraktionen. Hastigheten av disproportionering underlättas också av det mer elektronegativa syret på acceptormolekylen.
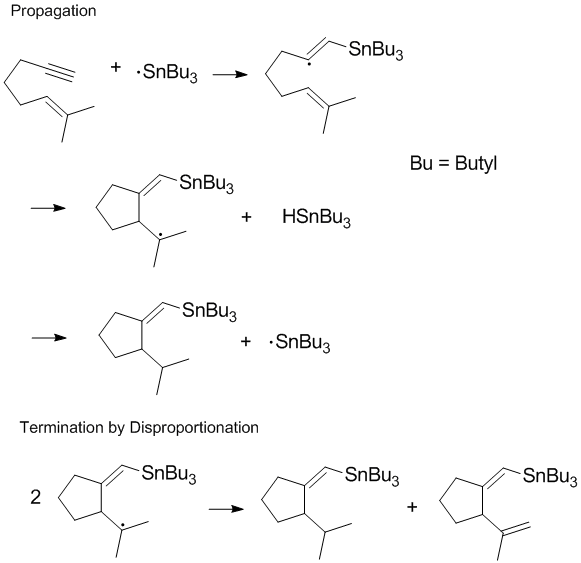
Avslutande av kedjeprocesser
Många radikala processer involverar kedjereaktioner eller kedjeförökning med disproportionering och rekombination som sker i reaktionens slutsteg. Avslutande kedjeförökning är ofta mest betydelsefull under polymerisation eftersom den önskade kedjeförökningen inte kan ske om disproportionering och rekombinationsreaktioner lätt inträffar. Att kontrollera termineringsprodukter och reglera disproportionering och rekombinationsreaktioner i slutsteget är viktiga överväganden i radikalkemi och polymerisation . I vissa reaktioner (som den som visas nedan) kan en eller båda avslutningsvägarna hindras av steriska effekter eller lösningsmedelseffekter .
Minskar disproportionering i levande friradikalpolymerisation
Många polymerkemister är angelägna om att begränsa graden av disproportionering under polymerisation. Även om disproportionering resulterar i bildning av en ny dubbelbindning som kan reagera med polymerkedjan, bildas också ett mättat kolväte , och kedjereaktionen fortskrider således inte lätt. Under levande friradikalpolymerisation avlägsnas termineringsvägar för en växande polymerkedja. Detta kan uppnås genom flera metoder, varav en är reversibel terminering med stabila radikaler. Nitroxidradikaler och andra stabila radikaler minskar rekombinations- och disproportioneringshastigheter och kontrollerar koncentrationen av polymera radikaler.