Provberedning i masspektrometri
Provberedning för masspektrometri används för optimering av ett prov för analys i en masspektrometer (MS). Varje joniseringsmetod har vissa faktorer som måste beaktas för att den metoden ska vara framgångsrik, såsom volym, koncentration , provfas och analytlösningens sammansättning . Möjligen är den viktigaste faktorn vid provberedningen att veta vilken fas provet måste vara i för att analysen ska bli framgångsrik. I vissa fall måste själva analyten renas innan den kommer in i jonkällan . I andra situationer är matrisen , eller allt i lösningen som omger analyten, den viktigaste faktorn att överväga och justera. Ofta kan själva provberedningen för masspektrometri undvikas genom att koppla masspektrometri till en kromatografimetod , eller någon annan form av separation innan man går in i masspektrometern. I vissa fall måste själva analyten justeras så att analys är möjlig, såsom i proteinmasspektrometri , där proteinet av intresse vanligtvis klyvs till peptider före analys, antingen genom nedbrytning i gel eller genom proteolys i lösning.
Provfas
| Provfas | Joniseringsmetod |
|---|---|
| Fast | Fältdesorption |
| Plasmadesorption | |
| Fast Atom Bombardment (FAB) | |
| Sekundär jon (SIMS) | |
| Omgivande jonisering | |
| Lösning | Matrix-assisterad laserdesorption jonisering (MALDI) |
| Elektrospray (ESI) | |
| Atmosfäriskt tryck kemisk jonisering (APCI) | |
| Omgivande jonisering | |
| Gas | Elektronjonisering |
| Fotojonisering | |
| Kemisk jonisering |
Det första och viktigaste steget i provberedningen för masspektrometri är att bestämma vilken fas provet behöver vara i. Olika joniseringsmetoder kräver olika provfaser. Fastfasprover kan joniseras genom metoder som fältdesorption , plasmadesorption , snabb atombombardement och sekundär jonisering . Vätskor med analyten löst i dem, eller lösningar, kan joniseras genom metoder som matrisassisterad laserdesorption , elektrosprayjonisering och kemisk jonisering vid atmosfärstryck . Både fasta och flytande prover kan joniseras med omgivande joniseringstekniker .
Gasprover, eller flyktiga prover, kan joniseras med metoder som elektronjonisering , fotojonisering och kemisk jonisering .
Dessa listor är det vanligaste materiatillståndet för varje joniseringsmetod, men joniseringsmetoderna är inte nödvändigtvis begränsade till dessa materiatillstånd. Till exempel, snabb atombombardementjonisering används vanligtvis för att jonisera fasta prover, men denna metod används vanligtvis på fasta ämnen lösta i lösningar, och kan också användas för att analysera komponenter som har gått in i gasfasen.
Kromatografi som provberedningsmetod
I många masspektrometriska joniseringsmetoder måste provet vara i vätske- eller gasfas för att joniseringsmetoden ska fungera. Provberedning för att säkerställa korrekt jonisering kan vara svårt, men kan göras lättare genom att koppla masspektrometern till någon kromatografisk utrustning. Gaskromatografi (GC) eller vätskekromatografi (LC) kan användas som provberedningsmetod.
Gaskromatografi
GC är en metod som involverar separation av olika analyter i ett prov av blandade gaser. De separerade gaserna kan detekteras på flera sätt, men en av de mest kraftfulla detektionsmetoderna för gaskromatografi är masspektrometri. Efter att gaserna separerat går de in i masspektrometern och analyseras. Denna kombination separerar inte bara analyterna, utan ger strukturell information om var och en. GC-provet måste vara flyktigt eller kunna gå in i gasfasen, samtidigt som det är termiskt stabilt så att det inte bryts ner när det värms upp för att gå in i gasfasen. Masspektrometrijoniseringstekniker som kräver att provet är i gasfas har liknande problem.
Elektronjonisering (EI) i masspektrometri kräver prover som är små molekyler, flyktiga och termiskt stabila, liknande den för gaskromatografi. Detta säkerställer att så länge som GC utförs på provet innan det går in i masspektrometern, kommer provet att förberedas för jonisering av EI.
Kemisk jonisering (CI) är en annan metod som kräver att proverna är i gasfas. Detta för att provet ska kunna reagera med en reagensgas för att bilda en jon som kan analyseras med masspektrometern. CI har många av samma krav vid provberedning som EI, såsom provets flyktighet och termisk stabilitet. GC är användbar för provberedning för denna teknik också. En fördel med CI är att större molekyler separerade av GC kan analyseras med denna joniseringsmetod. CI har ett större massintervall än EI och kan analysera molekyler som EI kanske inte kan. CI har också fördelen att vara mindre skadlig för provmolekylen, så att mindre fragmentering sker och mer information om den ursprungliga analyten kan fastställas.
Fotojonisering (PI) var en metod som först användes som en joniseringsmetod för att detektera gaser separerade av GC. År senare användes den också som en detektor för LC, även om proverna måste förångas först för att detekteras av fotojoniseringsdetektorn. Så småningom applicerades PI på masspektrometri, särskilt som en joniseringsmetod för gaskromatografi-masspektrometri . Provberedning för PI inkluderar att först säkerställa att provet är i gasfas. PI joniserar molekyler genom att excitera provmolekylerna med fotoner av ljus. Denna metod fungerar bara om provet och andra komponenter i gasfasen exciteras av olika våglängder av ljus. Det är viktigt när man förbereder provet, eller fotonkällan, att joniseringens våglängder justeras för att excitera provanalyten och inget annat.
Vätskekromatografi
Vätskekromatografi (LC) är en metod som på något sätt är kraftfullare än GC, men som lika enkelt kan kopplas till masspektrometri. I LC kan bekymmer med provberedning vara minimala. I LC kan både den stationära och mobila fasen påverka separationen, medan i GC endast den stationära fasen bör ha inflytande. Detta gör att provberedningen blir minimal om man är villig att justera den stationära fasen eller den mobila fasen innan provet körs. Det primära problemet är koncentrationen av analyt. Om koncentrationen är för hög kan separationen misslyckas, men masspektrometri som detektionsmetod kräver inte fullständig separation, vilket visar en annan fördel med att koppla LC till en masspektrometer.
LC kan kopplas till masspektrometri genom förångning av vätskeproverna när de kommer in i masspektrometern. Denna metod kan möjliggöra joniseringsmetoder som kräver att gasformiga prover används, såsom CI eller PI, särskilt kemisk jonisering vid atmosfärstryck eller fotojonisering vid atmosfäriskt tryck, vilket möjliggör fler interaktioner och mer jonisering. Andra joniseringsmetoder kräver kanske inte att vätskeprovet förångas och kan analysera själva vätskeprovet. Ett exempel är snabbatombombardementjonisering som kan göra det möjligt för vätskeprover som separeras av LC:n att flöda in i joniseringskammaren och lätt joniseras. Den vanligaste joniseringsmetoden kopplad till LC är någon form av sprayjonisering, som inkluderar termosprayjonisering och vanligare elektrosprayjonisering (ESI).
Termospray utvecklades först som ett sätt att effektivt ta bort lösningsmedel och förånga prover lättare. Denna metod innebär att vätskeprovet från LC strömmar genom en elektriskt uppvärmd förångare som helt enkelt värmer provet, tar bort eventuellt lösningsmedel och därför sätter provet i gasfas. Elektrosprayjonisering (ESI) liknar termospray i principen att ta bort det flytande lösningsmedlet från provet så mycket som möjligt, vilket skapar laddade provmolekyler antingen i små droppar eller i gasform. Studier har visat att ESI kan vara så mycket som tio gånger känsligare än andra joniseringsmetoder kopplade till LC. Spraymetoderna är särskilt användbara med tanke på att icke-flyktiga prover lätt kan analyseras genom denna metod eftersom provet inte i sig förvandlas till en gas, utan vätskan avlägsnas helt enkelt, vilket trycker in provet i en gasformig eller dimmig fas.
Ett provberedningsproblem med vätskekromatografi-masspektrometri är möjliga matriseffekter på grund av närvaron av bakgrundsmolekyler. Dessa matriseffekter har visat sig minska signalen i metoder som PI och ESI med så mycket som 60 % beroende på provet som analyseras. Matriseffekten kan också orsaka en ökning av signalen, vilket ger falskt positiva resultat. Detta kan korrigeras genom att rena provet så mycket som möjligt innan LC utförs, men i fallet med att analysera miljöprover där allt i provet är oroande kanske provberedningen inte är den idealiska lösningen för att åtgärda problemet. En annan metod som kan användas för att åtgärda problemet är att använda standardmetoden för tillägg.
Snabbt atombombardement
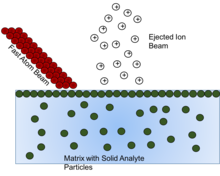
Fast atom bombardment (FAB) är en metod som innebär att man använder en stråle av högenergiatomer för att träffa en yta och generera joner . Dessa fasta analytpartiklar måste lösas i någon form av matris eller icke-flyktig vätska för att skydda och hjälpa till med joniseringen av den fasta analyten. Det har visat sig att när matrisen utarmas, minskar jonbildningen, så att välja rätt matrisförening är avgörande.
Det övergripande målet med matrisföreningen är att presentera provet för atomstrålen vid en hög rörlig ytkoncentration . För maximal känslighet bör provet bilda ett perfekt monoskikt vid ytan av ett substrat med låg flyktighet. Denna monoskiktseffekt kan ses genom att när en viss koncentration av analyt i matrisen uppnåtts, ses varje koncentration över den inte uppvisa någon effekt, eftersom när monskiktet väl har bildats finns eventuell ytterligare analyt under monoskiktet och därför inte påverkas av atomstrålen. Koncentrationen som behövs för att orsaka denna effekt ses förändras när mängden icke-flyktig matris ändras. Så koncentrationen av fast analyt måste beaktas vid beredningen av lösningen för analys så att signalen från "dold" analyt inte missas.
För att välja matris för varje fast analyt måste tre kriterier beaktas. Först bör den lösa upp den fasta föreningen som ska analyseras (med eller utan hjälp av ett hjälplösningsmedel eller tillsats), så att molekyler av den föreningen kan diffundera till ytskikten och fylla på provmolekylerna som har joniserats eller förstörts genom interaktion med den snabba atomstrålen. En annan mekanism för förklaring av jonbildning i FAB involverar tanken att förstoftning sker från bulken snarare än ytan, men i så fall är lösligheten fortfarande till stor del viktig för att säkerställa homogeniteten hos fast analyt i bulklösningen. För det andra bör matrisen ha en låg flyktighet under masspektrometerns förhållanden. Som nämnts ovan, när matrisen är utarmad, minskar joniseringen också, så att upprätthålla matrisen är avgörande. För det tredje bör matrisen inte reagera med den fasta analyten i fråga, eller om den reagerar bör den vara på ett förståeligt och reproducerbart sätt. Detta säkerställer reproducerbarhet av analys och identifiering av den faktiska analyten snarare än ett derivat av analyten.
De vanligast använda föreningarna som en matris är variationer av glycerol , såsom glycerol, deuteroglycerol, tioglycerol och aminoglycerol. Om provet inte kan lösas upp i den valda matrisen, såsom glycerol, kan ett hjälplösningsmedel eller tillsats blandas med matrisen för att underlätta upplösningen av den fasta analyten. Till exempel klorofyll A helt olösligt i glycerol, men genom att blanda i en liten mängd Triton X-100 , ett derivat av polyetylenglykol , blir klorofyllet mycket lösligt i matrisen. Det är viktigt att notera att även om en bra signal kan uppnås genom glycerol eller glycerol med en tillsats, kan det finnas andra matrisföreningar som kan erbjuda en ännu bättre signal. Optimering av matrisföreningar och koncentration av fast analyt är avgörande för FAB-mätningar.
Sekundär jonmasspektrometri
Sekundär jonmasspektrometri (SIMS) är en metod som mycket liknar FAB genom att en stråle av partiklar skjuts mot ytan av ett prov för att orsaka förstoftning , där molekylerna i provet joniserar och lämnar ytan, vilket möjliggör för jonerna eller provet som ska analyseras. Den primära skillnaden är att i SIMS avfyras en jonstråle mot ytan, men i FAB avfyras en atomstråle mot ytan. Den andra primära skillnaden, som är mer intressant för den här sidan, är att SIMS, till skillnad från FAB, vanligtvis utförs på ett fast prov med lite provberedning som krävs.
Det viktigaste med SIMS är att se till att provet är stabilt under ultrahögt vakuum eller tryck mindre än 10-8 torr . Naturen hos det ultrahöga vakuumet är att det säkerställer att provet förblir konstant under analysen samt att den höga energijonstrålen träffar provet. Ultrahögt vakuum löser många av de problem som måste beaktas vid provberedningen. När man förbereder provet för analys är en annan sak som bör beaktas filmens tjocklek. Typiskt, om ett tunt monolager kan avsättas på ytan av en ädelmetall , bör analysen vara framgångsrik. Om filmtjockleken är för stor, vilket är vanligt i verklighetsanalyser, kan problemet lösas med metoder som att avsätta en perforerad silverfolie över ett nickelgaller på filmytan. Detta ger liknande resultat som tunna filmer avsatta direkt på en ädelmetall.
Matrisassisterad laserdesorption/jonisering
För matrisassisterad laserdesorption/jonisering (MALDI) masspektrometri blandas ett fast eller flytande prov med en matrislösning för att hjälpa provet att undvika processer som aggregation eller utfällning , samtidigt som det hjälper provet att förbli stabilt under joniseringsprocessen. Matrisen kristalliseras med provet och avsätts sedan på en provplatta, som kan vara gjord av en rad olika material, från inerta metaller till inerta polymerer. Matrisen som innehåller provmolekylerna överförs sedan till gasfasen genom pulsad laserbestrålning . Matrisens sammansättning, interaktioner mellan provet och matrisen och hur provet deponeras är alla extremt viktiga under provberedningen för att säkerställa bästa möjliga resultat.
Valet av en matris är det första steget när man förbereder prover för MALDI-analys. De primära målen för matrisen är att absorbera energin från en laser och på så sätt överföra den till analytmolekylerna och att separera analytmolekylerna från varandra. En övervägande som bör beaktas vid val av matris är vilken typ av analytjon som förväntas eller önskas. Att känna till surheten eller basiciteten hos analytmolekylen jämfört med till exempel matrisens surhet eller basicitet är värdefull kunskap vid val av matris. Matrisen ska inte konkurrera med analytmolekylen, så matrisen ska inte vilja bilda samma typ av jon som analyten. Till exempel, om den önskade analyten har en hög mängd surhet, skulle det vara logiskt att välja en matris med en hög mängd basicitet för att undvika konkurrens och underlätta bildandet av en jon. Matrisens pH kan också användas för att välja vilket prov du vill få spektra för. Till exempel, när det gäller proteiner, kan ett mycket surt pH visa väldigt lite av peptidkomponenterna , men kan visa mycket bra signal för de komponenter som är större. Om pH höjs mot ett mer basiskt pH blir mindre komponenter lättare att se.
Koncentrationen av salt i provet är en faktor som måste beaktas vid beredning av ett MALDI-prov också. Salter kan hjälpa ett MALDI-spektra genom att förhindra aggregering eller utfällning samtidigt som provet stabiliseras. Emellertid kan störande signaler observeras på grund av sidoreaktioner av matrisen med provet, såsom i fallet att matrisen interagerar med alkalimetalljoner, vilket kan försämra analysen av spektra. Vanligtvis blir mängden salt i matrisen bara ett problem i mycket höga koncentrationer, såsom 1 molar . Problemet med att ha för hög koncentration av salt i provet kan lösas genom att först köra lösningen genom vätskekromatografi för att hjälpa till att rena provet, men denna metod är tidskrävande och resulterar i att en del av provet som ska analyseras försvinner. . En annan metod är fokuserad på rening när provlösningen deponerats på provsonden. Många provsonder kan utformas för att ha ett membran på ytan som selektivt kan binda provet i fråga till sondytan. Ytan kan sedan sköljas av för att avlägsna alla onödiga salter eller bakgrundsmolekyler. Matrisen med lämplig saltkoncentration kan sedan avsättas direkt på provet på sondens yta och kristalliseras där. Trots dessa negativa effekter av saltkoncentration är ett separat avsaltningssteg vanligtvis inte nödvändigt när det gäller proteiner , eftersom valet av lämpliga buffertsalter förhindrar uppkomsten av detta problem.
Hur provet och matrisen deponeras på ytan av provsonden måste också beaktas vid provberedningen. Den torkade droppmetoden är den enklaste av deponeringsmetoderna. Matrisen och provlösningen blandas tillsammans och sedan placeras en liten droppe av blandningen på provsondens yta och får torka, så att den kristalliserar. Sandwichmetoden innebär att ett lager av matris läggs på ytan av sonden och låter den torka. En droppe av provet följt av en droppe ytterligare matris appliceras sedan på lagret av torkad matris och får också torka. Variationer på sandwichtekniken innebär att matrisen deponeras på ytan och sedan deponeras provet direkt ovanpå matrisen. En särskilt användbar metod involverar avsättning av matrislösningen på ytan av provsonden i ett lösningsmedel som kommer att avdunsta mycket snabbt, vilket bildar ett mycket tunt fint lager av matris. Provlösningen placeras sedan ovanpå matrisskiktet och tillåts att avdunsta långsamt, varigenom provet integreras i det översta skiktet av matris när provlösningen avdunstar. Ett ytterligare problem när provet deponeras på ytan av sonden är lösligheten av provet i matrisen. Om provet är olösligt i matrisen måste ytterligare metoder användas. En metod som används i detta fall innefattar mekanisk malning och blandning av fasta prov och fasta matriskristaller. När det har blandats väl kan detta pulver avsättas på ytan av provsonden i fri pulverform eller som ett piller. En annan möjlig metod är att placera provet på ytan av sonden och applicera förångad matris på provsonden för att tillåta matrisen att kondensera runt provet.
Elektrosprayjonisering
Elektrosprayjonisering (ESI) är en teknik som innebär att man använder höga spänningar för att skapa en elektrospray , eller en fin aerosol som skapas av de höga spänningarna. ESI-provberedning kan vara mycket viktigt och kvaliteten på resultaten kan i hög grad bestämmas av provets egenskaper. ESI-experiment kan köras on-line eller offline. Vid on-line mätningar är masspektrometern ansluten till en vätskekromatograf och när proverna separeras joniseras de in i masspektrometern av ESI-systemet; provberedningen utförs faktiskt före LC-separationen. Vid off-line mätningar appliceras analytlösningen direkt på masspektrometern med en spraykapillär. Off-line provberedning har många överväganden, såsom det faktum att kapillären som används tillåter applicering av volymer i nanoliterintervallet, som kan innehålla en koncentration som är för liten för analys av många föreningar, såsom proteiner. Ett ytterligare problem kan vara förlust av ESI-signal på grund av interferens mellan analytprovet och bakgrundskomponenterna. Tyvärr har det visat sig att provberedningen i sig endast kan mildra detta problem något, vilket mer beror på själva analytens natur än beredningen. I ESI kommer det huvudsakliga problemet inte från reaktioner i gasfasen utan snarare från problem som involverar lösningsfasen för själva dropparna. Problem kan bero på att icke-flyktiga ämnen finns kvar i dropparna, vilket kan förändra effektiviteten av droppbildning eller droppavdunstning, vilket i sin tur påverkar mängden laddade joner i gasfasen som i slutändan når masspektrometern. Dessa problem kan fixas på flera sätt, inklusive att öka mängden koncentration av analyt jämfört med matris i provlösningen eller genom att köra provet genom en mer omfattande kromatografisk teknik före analys. Ett exempel på en kromatografisk teknik som kan hjälpa till med signalen i ESI involverar användning av 2-D vätskekromatografi, eller körning av provet genom två separata kromatografikolonner , vilket ger bättre separation av analyten från matrisen.
ESI-variationer
Det finns några ESI-metoder som kräver lite eller ingen provberedning. En sådan metod är en metod som kallas extraktiv elektrosprayjonisering (EESI). Denna metod innebär att en elektrospray av lösningsmedel riktas i en vinkel mot en annan spray av provlösningen, producerad av en separat nebulisator. Denna metod kräver ingen provberedning eftersom elektrosprayen av lösningsmedel extraherar provet från den komplexa blandningen, vilket effektivt tar bort eventuella bakgrundsföroreningar. En annan särskilt kraftfull variant av ESI är desorptionselektrosprayjonisering (DESI), som innebär att en elektrospray riktas mot en yta med provet avsatt ovanpå. Provet joniseras i elektrosprayen när det stänker från ytan och går sedan till masspektrometern. Denna metod är viktig eftersom ingen provförberedelse behövs för denna metod. Ett prov behöver helt enkelt läggas på en yta, till exempel papper. Atmosfäriskt tryck kemisk jonisering (APCI) liknar ESI genom att provet nebuliseras i droppar som sedan förångas och lämnar efter sig en laddad jon som ska analyseras. APCI upplever få av de negativa matriseffekter som ESI upplever på grund av det faktum att jonisering sker i gasfasen i denna metod snarare än i vätskedropparna som i ESI och det faktum att det i APCI finns en överflöd av reaktionsgas, alltså minimera effekten av matrisen på joniseringsprocessen.
Protein ESI
En viktig tillämpning för ESI är området för proteinmasspektrometri . Här används MS för identifiering och dimensionering av proteiner. Identifieringen av ett proteinprov kan göras i en ESI-MS genom de novo peptidsekvensering (med tandemmasspektrometri ) eller peptidmassfingeravtryck . Båda metoderna kräver tidigare nedbrytning av proteiner till peptider, mestadels åstadkoms enzymatiskt med användning av proteaser . Såväl för digestion i lösning som för in-gel digestion behövs buffrade lösningar, vars halt i salter är för hög och i analyt är för låg för en framgångsrik ESI-MS-mätning. Därför utförs ett kombinerat avsaltnings- och koncentreringssteg. används en omvänd fas- vätskekromatografi , där peptiderna förblir bundna till kromatografimatrisen medan salterna avlägsnas genom tvättning. Peptiderna kan elueras från matrisen genom användning av en liten volym av en lösning innehållande en stor del organiskt lösningsmedel, vilket resulterar i minskningen av den slutliga volymen av analyten. I LC-MS realiseras avsaltningen/koncentrationen med en pre-kolonn, vid off-line mätningar används omvänd fas mikrokolonner, som kan användas direkt med mikroliterpipetter . Här elueras peptiderna med spraylösningen innehållande en lämplig portion organiskt lösningsmedel. Den resulterande lösningen (vanligtvis några mikroliter) berikas med analyten och kan, efter överföring till spraykapillären, användas direkt i MS.