Proteinkontaktkarta
En proteinkontaktkarta representerar avståndet mellan alla möjliga aminosyrarestpar i en tredimensionell proteinstruktur med användning av en binär tvådimensionell matris . För två rester och elementet i matrisen 1 om de två resterna är närmare än ett förutbestämt tröskelvärde, och 0 annars. Olika kontaktdefinitioner har föreslagits: Avståndet mellan Ca - Ca - atomen med tröskelvärdet 6-12 Å ; avstånd mellan Cp - Cp - atomer med tröskelvärde 6-12 Å (Ca används för Glycin ); och avståndet mellan sidokedjans massacentrum .
Översikt
Kontaktkartor ger en mer reducerad representation av en proteinstruktur än dess fullständiga 3D-atomkoordinater. Fördelen är att kontaktkartor är oföränderliga för rotationer och översättningar. De är lättare att förutsäga av maskininlärningsmetoder . Det har också visat sig att det under vissa omständigheter (t.ex. lågt innehåll av felaktigt förutsagda kontakter) är möjligt att rekonstruera 3D-koordinaterna för ett protein med hjälp av dess kontaktkarta.
Kontaktkartor används också för proteinöverlagring och för att beskriva likheter mellan proteinstrukturer. De förutsägs antingen från proteinsekvens eller beräknas från en given struktur.
Kontaktkarta förutsägelse
Med tillgången till ett stort antal genomiska sekvenser blir det möjligt att analysera sådana sekvenser för samutvecklande rester . Effektiviteten av detta tillvägagångssätt beror på det faktum att en mutation i position i i ett protein är mer sannolikt associerad med en mutation i position j än med en tillbakamutation i i om båda positionerna är funktionellt kopplade (t.ex. genom att delta i en enzymatisk domän, eller genom att vara intilliggande i ett veckat protein, eller till och med genom att vara intilliggande i en oligomer av det proteinet).
sådana kopplade restpar från en multipelsekvensinriktning : observerade mot förväntade frekvenser av restpar (OMES); McLachlan-baserad substitutions-korrelation (McBASC); statistisk kopplingsanalys ; Ömsesidig information (MI) baserade metoder; och nyligen direktkopplingsanalys (DCA).
Maskininlärningsalgoritmer har kunnat förbättra MSA-analysmetoder, speciellt för icke-homologa proteiner (dvs grunda MSA).
Förutspådda kontaktkartor har använts för att förutsäga membranproteiner där helix-helix-interaktioner är inriktade på.
HB plot
Kunskap om sambandet mellan ett proteins struktur och dess dynamiska beteende är avgörande för att förstå proteinfunktionen. Beskrivningen av en tredimensionell proteinstruktur som ett nätverk av vätebindningsinteraktioner ( HB-plot ) introducerades som ett verktyg för att utforska proteinstruktur och funktion. Genom att analysera nätverket av tertiära interaktioner kan den möjliga spridningen av information inom ett protein undersökas.
HB plot erbjuder ett enkelt sätt att analysera protein sekundär struktur och tertiär struktur . Vätebindningar som stabiliserar sekundära strukturella element ( sekundära vätebindningar ) och de som bildas mellan avlägsna aminosyrarester - definierade som tertiära vätebindningar - kan lätt urskiljas i HB-plot, sålunda kan aminosyrarester involverade i stabilisering av proteinstruktur och funktion identifieras.
Funktioner
vätebindningsinteraktioner mellan huvudkedja-huvudkedja, huvudkedja- sidokedja och sidokedja-sidokedja . Bifurkerade vätebindningar och multipla vätebindningar mellan aminosyrarester ; och vätebindningar inom och mellan kedjorna är också indikerade på diagrammen. Tre klasser av vätebindningar särskiljs genom färgkodning; korta (avstånd mindre än 2,5 Å mellan donator och acceptor), mellanliggande (mellan 2,5 Å och 3,2 Å) och långa vätebindningar (större än 3,2 Å).
Sekundära strukturelement i HB-plot
I representationer av HB-plotten kan karakteristiska mönster av sekundära strukturelement lätt kännas igen, enligt följande:
- Helices kan identifieras som remsor direkt intill diagonalen.
- Antiparallella beta-ark visas i HB-plot som tvärdiagonala.
- Parallella betablad visas i HB-diagrammet som parallella med diagonalen.
- Slingor visas som avbrott i diagonalen mellan de tvärdiagonala beta-arkmotiven .
Exempel på användning
Cytokrom P450s
Cytokrom P450s (P450s) är xenobiotiska metaboliserande membranbundna hem -innehållande enzymer som använder molekylärt syre och elektroner från NADPH cytokrom P450 reduktas för att oxidera sina substrat . CYP2B4, en medlem av cytokrom P450-familjen är det enda proteinet inom denna familj, vars röntgenstruktur i både öppen 11 och sluten form 12 är publicerad. Jämförelsen av de öppna och slutna strukturerna av CYP2B4-strukturer avslöjar storskalig konformationell omarrangering mellan de två tillstånden, med den största konformationsförändringen kring resterna 215-225, som är vida öppen i ligandfritt tillstånd och stängd efter ligandbindning; och området runt slingan C nära hemen.
En undersökning av HB-diagrammet för det stängda och öppna tillståndet av CYP2B4 visade att omarrangemanget av tertiära vätebindningar var i utmärkt överensstämmelse med den nuvarande kunskapen om cytokrom P450 katalytiska cykeln .
Det första steget i P450 katalytisk cykel identifieras som substratbindning. Preliminär bindning av en ligand nära ingången bryter vätebindningarna S212-E474, S207-H172 i den öppna formen av CYP2B4 och vätebindningarna E218-A102, Q215-L51 bildas som fixerar ingången i den slutna formen som HB-diagrammet avslöjar .
Det andra steget är överföringen av den första elektronen från NADPH via en elektronöverföringskedja. För elektronöverföringen sker en konformationsförändring som utlöser interaktion av P450 med NADPH cytokrom P450 reduktas. Brytning av vätebindningar mellan S128-N287, S128-T291, L124-N287 och bildande av S96-R434, A116-R434, R125-I435, D82-R400 vid NADPH-reduktasets bindningsställe för NADPH-cytokrom P450 i HCYB-plott4B-transenformen HCYB2B- transform . till ett konformationstillstånd, där bindning av NADPH cytokrom P450-reduktas sker.
I det tredje steget kommer syre in i CYP2B4 i det stängda tillståndet - det tillstånd där nybildade vätebindningar S176-T300, H172-S304, N167-R308 öppnar en tunnel som är exakt lika stor som en syremolekyl .
Lipocalin familj
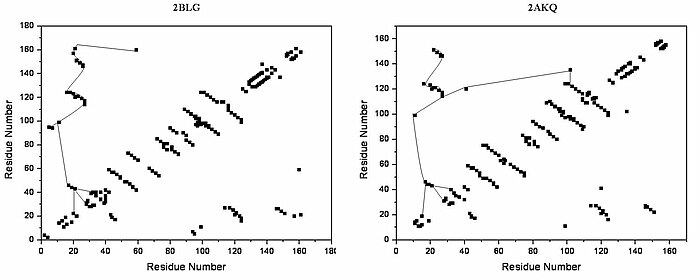
Lipokalinfamiljen är en stor och mångfaldig familj av proteiner med funktioner som . små hydrofoba molekyltransportörer Beta-laktoglobulin är en typisk medlem av lipokalinfamiljen. Beta-laktoglobulin visade sig ha en roll i transporten av hydrofoba ligander som retinol eller fettsyror . Dess kristallstruktur bestämdes [t.ex. Qin, 1998] med olika ligander och även i ligandfri form. Kristallstrukturerna som hittills har bestämts avslöjar att det typiska lipokalinet innehåller åtta-strängat antiparallellt fat arrangerat för att bilda en konisk central hålighet i vilken den hydrofoba liganden är bunden. Strukturen av beta-laktoglobulin avslöjar att den fatformade strukturen med proteinets centrala hålighet har en "ingång" omgiven av fem beta-loopar med centra runt 26, 35, 63, 87 och 111, som genomgår en konformationsförändring under ligandbindningen och stänga håligheten.
Den övergripande formen av beta-laktoglobulin är karakteristisk för lipokalinfamiljen. [ citat behövs ] I frånvaro av alfa-helixar försvinner nästan huvuddiagonalen och korsdiagonalerna som representerar beta-arken dominerar handlingen. Relativt lågt antal tertiära vätebindningar kan hittas i diagrammet, med tre högdensitetsregioner, varav en är ansluten till en slinga vid resterna runt 63, en andra är ansluten till slingan runt 87 och en tredje region som är ansluten till regionerna 26 och 35. Den femte slingan runt 111 representeras endast av en tertiär vätebindning i HB-diagrammet.
I den tredimensionella strukturen bildas tertiära vätebindningar (1) nära ingången, direkt involverade i konformationell omarrangemang under ligandbindning; och (2) längst ner på "pipan". HB-plottar av de öppna och slutna formerna av beta-laktoglobulin är mycket lika, alla unika motiv kan kännas igen i båda formerna. Skillnad i HB-plots av öppen och ligandbunden form visar få viktiga individuella förändringar i tertiärt vätebindningsmönster. Speciellt kan bildandet av vätebindningar mellan Y20-E157 och S21-H161 i sluten form vara avgörande vid konformationell omarrangemang. Dessa vätebindningar ligger i botten av kaviteten, vilket tyder på att stängningen av ingången till ett lipokalin börjar när en ligand nådde botten av kaviteten och bröt vätebindningarna R123-Y99, R123-T18 och V41-Q120. Lipokaliner är kända för att ha mycket låg sekvenslikhet med hög strukturell likhet. [ citat behövs ] De enda bevarade regionerna är exakt regionen runt 20 och 160 med en okänd roll.
Se även
- Ramachandran tomt
- Strukturell klassificering av proteiner
- CATH
- HB tomt
- Punktplot (bioinformatik)
- Självlikhetsmatris
externa länkar
- DISTILL — förutsägelse av proteinstrukturella egenskaper (inklusive kontaktkartor för proteinrester)
- Structural Proteomics Tools — inkluderar aminosyrakontaktkartor
- ProfCon — förutsägelse av interresidue-kontakter
- TMHcon — förutsägelse av helix-helix-kontakter specifikt inom de transmembrana delarna av membranproteiner
- TMhit — En ny prediktionsmetod för transmembran helix-helix-interaktion baserad på restkontakter [ död länk ]
- CMAPpro — En prognosserver för proteinkontaktkarta
- [1] — Ett verktyg för Protein Contact-Map Visualization i jerseysforcheapshop