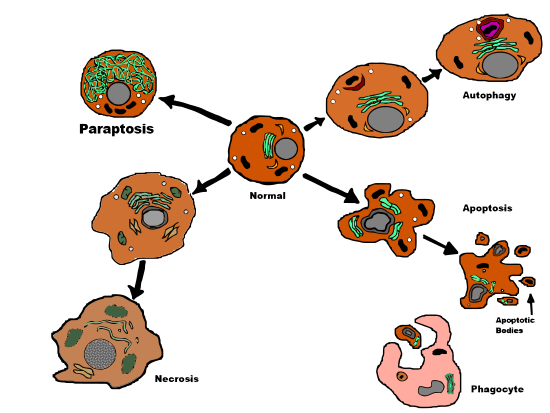
Paraptos
Paraptosis (från grekiskans παρά para , "släkt med" och apoptos ) är en typ av programmerad celldöd , morfologiskt skild från apoptos och nekros . De definierande egenskaperna hos paraptos är cytoplasmatisk vakuolering , oberoende av kaspasaktivering och -hämning, och avsaknad av apoptotisk morfologi. Paraptos saknar flera av de kännetecknande egenskaperna hos apoptos, såsom membranblåsning , kromatinkondensering och kärnfragmentering . Liksom apoptos och andra typer av programmerad celldöd är cellen involverad i att orsaka sin egen död, och genuttryck krävs. Detta i motsats till nekros, som är oprogrammerad celldöd som är ett resultat av skada på cellen.
Paraptos har hittats i vissa utvecklingsmässiga och neurodegenerativa celldödsfall, såväl som inducerad av flera cancerläkemedel .
Paraptos erkändes inte som en form av celldöd av nomenklaturkommittén för celldöd i deras översiktsartikel 2018. Användningen av denna term avråddes uttryckligen av kommittén i sin revidering 2012
Historia
Den första rapporterade användningen av termen "paraptos" var av Sabina Sperandio et al. år 2000. Gruppen använde human insulinliknande tillväxtfaktor 1-receptor (IGF-1R) för att stimulera celldöd i 293T-celler och musembryonala fibroblaster , och observerade tydliga skillnader från andra former av celldöd. De myntade termen "paraptosis", härledd från den grekiska prepositionen para , som betyder bredvid eller relaterad till, och apoptos .
Medan Sperandio var först med att publicera termen paraptos, var detta inte första gången som celldöd med paraptosens egenskaper observerades. Termer som "cytoplasmatisk" och "celldöd av typ 3" hade tidigare använts för att beskriva dessa former av celldöd. Dessa former är mycket lika paraptos morfologiskt, och det är möjligt att vissa fall av celldöd som ursprungligen beskrevs som en av dessa former är förekomster av paraptos.
Morfologi
Paraptos är en form av typ III programmerad celldöd med en unik kombination av vissa apoptotiska och nekrotiska egenskaper. Paraptos visar inte kärnfragmentering , bildning av apoptotiska kroppar eller definitiv demonstration av kromatinkondensation - allt ses i apoptos. Istället visar paraptos en något primitiv celldödsväg, jämförbar med nekros, inklusive karakteristisk cytoplasmatisk vakuolbildning och sen mitokondriell svullnad och klumpar. Antalet och storleken på vakuoler ökar med tiden. Så småningom når vakuolstorlekarna en point of no return och cellen kan inte återhämta sig.
I likhet med apoptos kan färgningstekniker användas för att identifiera paraptotiska celler genom att framhäva translokationen av fosfatidylserin från plasmamembranets cytoplasmatiska (inre) broschyr till cellytan eller yttre broschyren.
Paraptosis morfologiska förändringar liknar de morfologiska förändringar som genomgår under utvecklingen av nervsystemet .
Stor strukturell omläggning
Nästan omedelbart kan större strukturella omarrangemang såsom rundade celler, cytoplasmatisk omorganisation och vakuolering av celler som genomgår paraptos ses genom ljusmikroskopi. Det finns fysisk förstoring av mitokondrierna och endoplasmatiskt retikulum. Detta svullna utseende kan tillskrivas intracellulär jonobalans och eventuell osmotisk lysis . När de väl spruckit frigörs partiklar och substanser, inklusive: (1) högrörlighetsgrupp B-1 ( HMGB1 ) (2) värmechockproteiner och (3) olika andra proteaser . Dessa ämnen är "farosignaler" och resulterar i inflammation.
Väg
Medan vissa mallar för programmerad celldöd har varit kända för att förlita sig på de novo proteinsyntes, avskräcks paraptotisk celldöd inducerad av IGFIR-IC i 293T-celler av aktinomycin D och cykloheximid , vilket visar ett beroende av transkription och translation.
Induktion av paraptos har bestämts förmedlas genom två positiva signaltransduktionsvägar, MAPK och JNK , genom att använda IGF-IR på receptornivå. Som sådan kan paraptos förhindras genom att hämma specifika proteinkinaser av dessa vägar.
AIP1- interaktion (via dess karboxylterminal ) med endofiliner kan inducera intracellulär vakuolbildning. AIP1/Alix fastställdes vara "den första specifika hämmaren" av paraptos.
Paraptosliknande fenotyp har också beskrivits i humana kolorektala cancerceller efter överaktivering av icke-receptortyrosinkinaset c-Src, vilket tyder på potentiell involvering av Src-signalering i paraptos.
Skillnader från andra celldödsvägar
Celldöd inducerad av IGFIR-IC i 293T-celler visade celldöd utan associerad kaspasaktivitet. Detta är i jämförelse med apoptos, där det proapoptotiska proteinet Bax inducerade kaspasaktivering och celldöd. Dessutom fann forskning att kaspashämmare (zVAD.fmk, p53 , BAF), x-kromosomkopplad inhibitor ( xiap ) och Bcl-xL (från Bcl-2-familjen) inte förhindrade celldöd i 293T-celler när de inducerades av IGFIR-IC. Därför drogs slutsatsen att paraptos skiljer sig från apoptos (celldöd typ 1) genom att vara opåverkad av hämmare av apoptos.
Vid apoptos hålls HMGB1 , ett kromatinprotein, kvar i kärnan för att resultera i formationer av apoptotiska kroppar, medan i paraptos HMGB1 frisätts.
Den mest avgörande skillnaden som observerats (i april 2014) mellan paraptos och autofagisk celldöd (celldöd typ 2) är paraptosens avsaknad av de karakteristiska autofagiska vakuolerna som ses vid autofagisk celldöd. Som väntat är autofagisk celldödshämmare (till exempel 3-metyladenin) ineffektiva för att hämma paraptos.
Jämförelse av celldödstyper
| Paraptos | Apoptos | Nekros | |
|---|---|---|---|
| Morfologi | |||
| Cytoplasmatisk vakuolering | Ja | Nej | Ja |
| Kromatinkondensation | Nej | Ja | Nej |
| Nukleär fragmentering | Nej | Ja | Nej |
| Apoptotiska kroppar | Nej | Ja | Nej |
| Mitokondriell svullnad | Ja | Ibland | Ja |
| Membran Blebbing | Nej | Ja | Ja, sent |
| Programmerad celldöd | Ja | Ja | Nej |
| Caspase aktivitet | Nej | Ja | Ibland |
| Inhibitorer | |||
| Actinomycin D, cykloheximid | Ja | Ibland | Nej |
| AIP1/Alix | Ja | Nej | Nej |
| Kaspashämmare (zVAD.fmk, p53, BAF) | Nej | Ja | Nej |
| Xiap | Nej | Ja | Nej |
| Bcl-XL | Nej | Ja | Vanligtvis inte |
Proteome profil
Celler upplever både morfologiska och proteomförändringar när de genomgår paraptos. Förändringar av strukturella, signaltransduktion och mitokondriella proteiner har alla observerats under paraptos.
Strukturella proteiner
I celler som genomgår paraptos:
- α-Tubulin är mer koncentrerat i endosomer och Golgi (lätt membran) och är mindre rikligt i cytosolen och det mörka membranet (består av mitokondrier och lysosomer ).
- β-Tubulin totalt sett minskas i paraptotiska cellfraktioner.
- Tropomyosin , i likhet med α-tubulin, visar en högre närvaro i endosomer och golgi, samtidigt som det har ett minskat överflöd i cytosolen och det mörka membranet.
Signaltransduktionsproteiner
PEBP, eller Raf- kinashämmarprotein (RKIP) minskar i paraptotiska celler, så resulterande nedreglering av PEBP och/eller andra kinashämmare verkar indikera deltagande i MAPK- och JNK - vägarna, eftersom minskat PEBP skulle tillåta nivåerna av MAPK och JNK ackumuleras tillräckligt för att vara tillräckligt för att inducera celldöd.
Mitokondrierproteiner
ATP-syntas är sammansatt av flera subenheter och finns i mitokondrierna. När man genomgick paraptos visades högre mängder ATP-syntas ß-subenhet i P20.
Mitokondriell färgning avslöjar att rundade paraptotiska celler med förhöjda nivåer av prohibitin verkar genomgå omorganisation av mitokondriella nätverk.
Paraptotiska celler visade en 3,4-faldig ökning av prohibitin. Ökade nivåer av prohibitin i konjugering med en paraptotisk stimulans kan resultera i celldöd som inte kan inhiberas av kaspasinhibitorer.
Potentiell medicinsk betydelse
Cancer
Många anticancerämnen har visat sig orsaka paraptos i ett stort antal mänskliga cancerceller. Detta inkluderar flera föreningar som härrör från naturliga källor såväl som metallkomplex. Paraptos är också ett intresseområde för cancerforskning som ett sätt att behandla apoptosresistenta cancerformer.
Paklitaxel , vanligen distribuerat under handelsnamnet Taxol, är ett cancerläkemedel som används för behandling av bröst- och äggstockscancer. Vid höga koncentrationer (70 μM) visade en studie att det inducerade en paraptosliknande celldöd och kunde vara en viktig mekanism för att behandla apoptosresistenta cancerformer.
Forskare har rapporterat att de upptäckt att γ-Tokotrienol , en form av vitamin E som härrör från palmolja, inducerade paraptosliknande celldöd i tjocktarmscancerceller . Tillsammans med att inducera paraptos undertryckte γ-tokotrienol också Wnt-signalvägen, som spelar en roll i tumörutvecklingen. Kombinationen av dessa två funktioner kan ge en ny mekanism för behandling av tjocktarmscancer.
Ångat amerikanskt ginsengextrakt har rapporterats "potentiellt döda kolorektala cancerceller". Specifikt är derivat av protopanaxadiol Rg3 och Rh2 de viktigaste ginsenosiderna som finns i extraktet. I kolorektala cancercellinjer, HCT116 , har cytosolisk vakuolisering inducerats av Rh2. Vidare inhiberades Rh2-inducerad vakuolisering av en MEK1/2-specifik hämmare U0126 , cykloheximid , vilket bekräftar två karakteristiska egenskaper för paraptos, signalering via MAP-kinas och krävde proteintranslation . Rh2 inducerar också ökade ROS- nivåer, vilket aktiverar NF-KB- signalvägen, medan blockering av ROS med NAC eller katalas förhindrar aktiveringen av NF-KB- signalering och ytterligare förbättrar celldöd inducerad av Rh2. Detta tyder på en antioxidantförstärkt anticancereffekt av Rh2.
Honokiol , en förening som härrör från Magnolia officinalis , kan inducera paraptos i humana leukemiceller . I NB4-cellinjen var paraptos den primära metoden för celldöd. I K562-celler var apoptos den primära mekanismen, med paraptos ibland. Forskare uppgav att detta tyder på att leukemi celldöd kan induceras av flera vägar.
I ett experiment orsakade ett fosfinkoppar(I)-komplex paraptos i tjocktarmscancerceller genom att inducera endoplasmatisk retikulumstress . Ett annat kopparkomplex, A0 tioxotriazol koppar (II) komplex, orsakade också paraptos i HT1080 fibrosarkomceller via endoplasmatisk retikulum stress och cytoplasmatisk vakuolisering. Tillsammans med cytotoxiska effekter såsom en ökning av oxiderat glutation och förhindrande av proteasomaktivitet , förhindrade A0 aktiviteten av kaspas-3, vilket kan hämma apoptos och få cellerna att dö via paraptos.
Neurodegenerativ celldöd
Aktiviteten hos däggdjurstumörsuppressorn p53 beror på nivåerna av en isoform av p53, p44. I ett experiment med transgena möss som hade ett överuttryck av p44 inträffade hyperaktivering av IGF-1R , vilket i sin tur ledde till accelererat åldrande och död. Mössen upplevde också neuronal död i delar av hjärnan relaterade till minnesbildning och återhämtning. Denna IGF-1R-inducerade neurodegeneration orsakades av både paraptos och autofagisk celldöd. IGF-1R är ett viktigt forskningsområde för neurodegenerativa sjukdomar, eftersom defekter i IGF-1R-signalering, inklusive ökade nivåer av IGF-1R, har hittats i hjärnan hos Alzheimerspatienter .
Andra exempel
Paraptosliknande programmerad celldöd har observerats i både växter och protister . Apoptotisk död som liknar den som finns hos djur förekommer inte i växter, på grund av att cellväggen hos växtceller förhindrar fagocytos . I ett experiment med tobak bleomycin för att introducera dubbelsträngbrott i cellernas DNA. Detta fick sedan celler att genomgå programmerad celldöd med avsevärd vakuolisering och frånvaro av DNA-fragmentering och kaspasinhibering, liknande paraptos. En studie med algen Dunaliella viridis visade protisters förmåga att genomgå programmerad celldöd via flera typer, inklusive paraptos och apoptos, beroende på olika miljöstimuli. En kombination av dessa faktorer har lett till spekulationer om att paraptos kan vara en uråldrig form av programmerad celldöd, bevarad över olika livsformer.