P-TEFb

Den positiva transkriptionsförlängningsfaktorn, P-TEFb , är ett multiproteinkomplex som spelar en väsentlig roll i regleringen av transkription av RNA-polymeras II (Pol II) i eukaryoter. Omedelbart efter initiering blir Pol II fångade i proximala pauspositioner för promotorn på majoriteten av mänskliga gener (Figur 1). P-TEFb är ett cyklinberoende kinas som kan fosforylera den DRB -känslighetsinducerande faktorn ( DSIF ) och negativ förlängningsfaktor (NELF), såväl som den karboxylterminala domänen av den stora subenheten av Pol II och detta orsakar övergången till produktiv förlängning som leder till till syntesen av mRNA. P-TEFb regleras delvis av en reversibel association med 7SK snRNP. Behandling av celler med P-TEFb-hämmarna DRB eller flavopidirol leder till förlust av mRNA- produktion och i slutändan celldöd.
Upptäckt, sammansättning och struktur
P-TEFb identifierades och renades som en faktor som behövs för generering av långa avloppstranskript med användning av ett in vitro-transkriptionssystem härlett från Drosophila-celler. Det är ett cyklinberoende kinas som innehåller den katalytiska subenheten, Cdk9 , och en regulatorisk subenhet, cyklin T i Drosophila. Hos människor finns det flera former av P-TEFb som innehåller Cdk9 och en av flera cyklinsubenheter, cyklin T1, T2 och K. P-TEFb associerar med andra faktorer, inklusive bromodomänproteinet BRD4, och finns associerat med ett stort komplex av proteiner som kallas superförlängningskomplexet. Viktigt, för AIDS-viruset, HIV , är P-TEFb målinriktat av HIV Tat -proteinet som kringgår normal cellulär P-TEFb-kontroll och direkt för P-TEFb till promotorns proximala pausade polymeras i HIV-genomet.
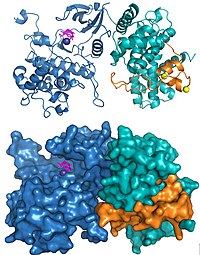
Strukturerna för humant P-TEFb innehållande Cdk9 och cyklin T1 och HIV Tat•P-TEFb-komplexet har lösts med hjälp av röntgenkristallografi. Den första strukturen som löstes visade att de två subenheterna var arrangerade som har hittats i andra cyklinberoende kinaser. Tre aminosyrasubstitutioner infördes oavsiktligt i subenheterna som användes för den ursprungliga strukturen och en efterföljande strukturbestämning med användning av de korrekta sekvenserna visade samma övergripande struktur med undantag för några signifikanta förändringar runt det aktiva stället. Strukturen av HIV Tat bunden till P-TEFb visade att det virala proteinet bildar omfattande kontakter med cyklin T1-subenheten (Figur 2).
Reglering av P-TEFb
På grund av sin centrala roll i att kontrollera eukaryota genuttryck, är P-TEFb föremål för sträng reglering på nivån av transkription av generna som kodar för subenheterna, translation av subenhets mRNA, omsättning av subenheterna och även genom en ovanlig mekanism som involverar 7SK snRNP. Som visas i figur 3 hålls P-TEFb i 7SK snRNP av det dubbelsträngade RNA-bindande proteinet HEXIM ( HEXIM1 eller HEXIM2 hos människor). HEXIM bundet till 7SK RNA eller något dubbelsträngat RNA binder till P-TEFb och hämmar kinasaktiviteten. Två andra proteiner finns alltid associerade med 7SK RNA. Det metylfosfasbegränsande enzymet MEPCE sätter en metylgrupp på gammafosfatet i den första nukleotiden av 7SK-RNA:t och det La-relaterade proteinet LARP7 binder till 3'-änden av 7SK. När P-TEFb extraheras från 7SK snRNP, genomgår 7SK RNA en konformationsförändring, HEXIM stöts ut och hnRNPs tar platsen för de borttagna faktorerna. Återsekvestreringen av P-TEFb kräver ytterligare en omarrangering av RNA:t, bindning av HEXIM och sedan P-TEFb. I snabbt växande celler är 7SK snRNP den dominerande formen av P-TEFb. För granskning.