Niob(V)-etoxid
 Skelettstruktur av niob(V)
|
|
| etoxididentifierare | |
|---|---|
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.019.814 |
| EG-nummer |
|
|
PubChem CID
|
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C10H25NbO5 _ _ _ _ _ | |
| Molar massa | 318,209 g mol -1 |
| Utseende | Färglös vätska |
| Densitet | 1,258 g cm −3 |
| Smältpunkt | 5 °C (41 °F; 278 K) |
| Kokpunkt | 203 °C (397 °F; 476 K) |
| N/A; reagerar med vatten | |
| Termokemi | |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
−1583,9 ± 2,7 kJ mol −1 |
|
Standardentalpi för förbränning (Δ c H ⦵ 298 ) |
−6872,6 ± 1,7 kJ mol −1 |
| Faror | |
| GHS- märkning : | |
 
|
|
| Fara | |
| H226 , H314 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P264 , P280 , P301 + P330+P331 , P303+P361+P353, P304+P3050+3P , P304+P3050+3P, P304 + P3050 +3P, 8 1 , P363 , P370 + P378 , P403+P235 , P405 , P501 | |
| NFPA 704 (branddiamant) | |
| Flampunkt | 36°C; 97°F; 309 K |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Niob(V)etoxid är en metallorganisk förening med formeln Nb 2 (OC 2 H 5 ) 10 . Det är en färglös vätska som löser sig i vissa organiska lösningsmedel men hydrolyserar lätt. Det används främst för sol-gel-bearbetning av material som innehåller nioboxider.
Strukturera
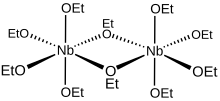
Metallalkoxider antar sällan monomera strukturer, och niob(V)-etoxid är inget undantag. Tidiga studier visade att niobalkoxider aggregerar i lösning som dimerer . Efterföljande kristallografisk analys fastställde att metoxiden och isopropoxiderna av niob antar bioktaedriska strukturer. Ur ett geometriskt perspektiv definierar de tio etoxidligandsyreatomerna i Nb 2 (OEt) 10 -molekylen i lösning ett par oktaedrar som delar en gemensam kant med de två niobatomerna placerade i deras centrum. Ur ett bindningsperspektiv är varje niobcentrum omgivet oktaedriskt av fyra monodentata och två överbryggande etoxidligander . Syreatomerna i de överbryggande etoxiderna är var och en bundna till båda niobcentra, och dessa två ligander är cis till varandra inom koordinationssfären . Formeln [(EtO) 4 Nb(μ-OEt)] 2 representerar mer omfattande denna dimera struktur, även om den förenklade formeln vanligtvis används för de flesta ändamål.
Förberedelser och reaktioner
Denna förening framställs genom saltmetates från niobpentaklorid (Et = C 2 H 5 ):
- 10 NaOEt + Nb 2 Cl 10 → Nb 2 (OC 2 H 5 ) 10 + 10 NaCl
Den viktigaste reaktionen av niobalkoxider är deras hydrolys för att producera filmer och geler av nioboxider. Även om dessa reaktioner är komplexa, kan de beskrivas med denna förenklade ekvation:
- Nb 2 (OC 2 H 5 ) 10 + 5 H 2 O → Nb 2 O 5 + 10 HOEt
Den termiska nedbrytningen av Nb(OC 2 H 5 ) 5 börjar över 325 – 350 °C. Detta kan observeras med QMS som en ökande mängd etanol och etan som frigörs. Dietyleter , C 2 H 5 OC 2 H 5 och niob(V)-oxid är de sönderdelningsprodukter som frigörs efter en atomskiktsavsättning eller kemisk ångavsättningsprocess . Nedbrytningsreaktionen kan sammanfattas som:
- Nb2 ( OC2H5 ) 10 → Nb2O5 + 5 O ( C2H5 ) 2 _ _ _ _
