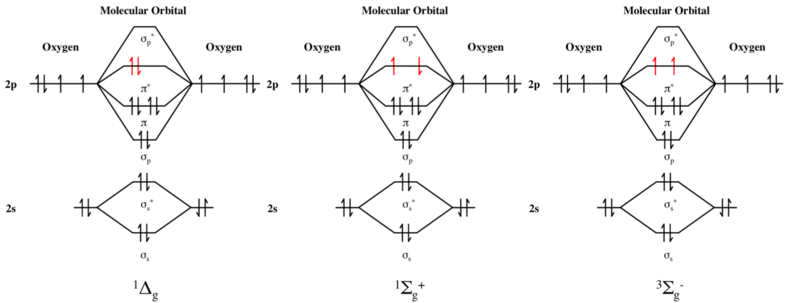Mångfald (kemi)
Inom spektroskopi och kvantkemi definieras mångfalden av en energinivå som 2S + 1 , där S är det totala snurrmomentet . Tillstånd med multiplicitet 1, 2, 3, 4, 5 kallas respektive singletter , dubletter , trillingar , kvartetter och kvintetter.
I grundtillståndet för en atom eller molekyl har de oparade elektronerna vanligtvis alla parallellt spinn. I detta fall är multipliciteten också lika med antalet oparade elektroner plus en.
Atomer
Mångfalden är ofta lika med antalet möjliga orienteringar av det totala spinnet i förhållande till det totala omloppsrörelsemängden L , och därför med antalet nära- degenererade nivåer som skiljer sig endast i sin spin-omloppsinteraktionsenergi .
är grundtillståndet för en kolatom 3 P. Den upphöjda trean (läs som triplett ) indikerar att multipliciteten 2S+1 = 3, så att det totala spinnet S = 1. Detta spinn beror på två oparade elektroner , som ett resultat av Hunds regel som gynnar den enda fyllningen av degenererade orbitaler. Tripletten består av tre tillstånd med spinnkomponenter +1, 0 och –1 längs riktningen för den totala omloppsrörelsens rörelsemängd, vilket också är 1 som indikeras av bokstaven P. Det totala rörelsemängdskvantumnumret J kan variera från L+S = 2 till L–S = 0 i heltalssteg, så att J = 2, 1 eller 0.
Emellertid är multipliciteten lika med antalet snurrorienteringar endast om S ≤ L. När S > L finns det endast 2L+1 orienteringar med totalt vinkelmoment möjliga, allt från S+L till SL. Kväveatomens grundtillstånd är ett 4 S-tillstånd, för vilket 2S + 1 = 4 i ett kvartetttillstånd , S = 3/2 på grund av tre oparade elektroner. För ett S-tillstånd är L = 0 så att J bara kan vara 3/2 och det finns bara en nivå även om multipliciteten är 4.
Molekyler
De flesta stabila organiska molekyler har kompletta elektronskal utan oparade elektroner och har därför singlettjordtillstånd. Detta gäller även för oorganiska molekyler som endast innehåller huvudgruppselement . Viktiga undantag är dioxygen (O 2 ) samt metylen (CH 2 ) och andra karbener .
Men högre spinngrundtillstånd är mycket vanliga i koordinationskomplex av övergångsmetaller . En enkel förklaring av spinntillstånden för sådana komplex tillhandahålls av kristallfältsteorin .
Dioxygen
Den högsta ockuperade orbitala energinivån av dioxygen är ett par antibindande π* -orbitaler. I grundtillståndet för dioxygen är denna energinivå upptagen av två elektroner med samma spinn, som visas i det molekylära orbitaldiagrammet . Molekylen har därför två oparade elektroner och är i ett tripletttillstånd.
Däremot är de första och andra exciterade tillstånden av dioxygen båda tillstånden av singlettsyre . Var och en har två elektroner med motsatt spin i π*-nivån så att S = 0 och multipliciteten är 2S + 1 = 1 som följd.
I det första exciterade tillståndet paras de två π*-elektronerna i samma orbital, så att det inte finns några oparade elektroner. I det andra exciterade tillståndet upptar emellertid de två π*-elektronerna olika orbitaler med motsatt spinn. Var och en är därför en oparad elektron, men det totala spinnet är noll och multipliciteten är 2S + 1 = 1 trots de två oparade elektronerna. Mångfalden av det andra exciterade tillståndet är därför inte lika med antalet oparade elektroner plus en, och regeln som vanligtvis är sann för grundtillstånd är ogiltig för detta exciterade tillstånd.
Karbener
Inom organisk kemi är karbener molekyler som har kolatomer med bara sex elektroner i sina valensskal och därför inte lyder oktettregeln . Karbener delas i allmänhet upp i singletkarbener och triplettkarbener , uppkallade efter deras spinnmångfald. Båda har två icke-bindande elektroner; i singlettkarbener existerar dessa som ett ensamt par och har motsatta snurr så att det inte finns något nettospinn, medan i triplettkarbener har dessa elektroner parallella spinn.
Se även
Bibliografi
- Atkins, Peter; de Paula, Julio (2006). Atkins' Physical Chemistry (8:e upplagan). USA: Oxford University Press . ISBN 0-7167-8759-8 .
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organisk kemi . USA: Oxford University Press . ISBN 0-19-850346-6 .
- Levine, Ira N. (1991). Quantum Chemistry (4:e upplagan). USA: Prentice-Hall . ISBN 0-205-12770-3 .
- Miessler, Gary L.; Tarr, Donald A. (1999). Oorganisk kemi (2:a upplagan). Prentice-Hall. ISBN 0-13-841891-8 .