Interstitiellt kollagenas
| interstitiellt kollagenasidentifierare | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Externa | |||||||||||||||||||||||||||||||||||||||||||||||
| ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Interstitiellt kollagenas , även känt som fibroblastkollagenas , och matrismetalloproteinas-1 (MMP-1) är ett enzym som hos människor kodas av MMP1 - genen . Genen är en del av ett kluster av MMP-gener som lokaliseras till kromosom 11q22.3. MMP-1 var det första kollagenaset från ryggradsdjur som både renades till homogenitet som ett protein och klonades som ett cDNA . MMP-1 har en uppskattad molekylvikt på 54 kDa.
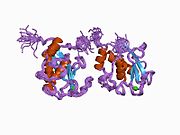
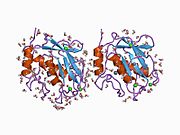
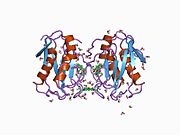
Strukturera
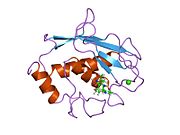
MMP-1 har en arketypisk struktur bestående av en pre-domän, en pro-domän, en katalytisk domän , en länkregion och en hemopexinliknande domän. Den primära strukturen för MMP-1 publicerades först av Goldberg, GI, et al. Två huvudnomenklaturer för den primära strukturen används för närvarande, den ursprungliga från vilken den första aminosyran börjar med signalpeptiden och en andra där den första aminosyran börjar räknas från prodomänen (proenzymnomenklaturen).
Katalytisk domän
De katalytiska domänerna av MMPs delar mycket liknande egenskaper, med en allmän form av oblate ellipsoid med en diameter på ~40 Å. Trots likheten mellan de katalytiska domänerna hos MMP:er, kommer denna post endast att fokusera på de strukturella egenskaperna hos MMP-1 katalytiska domäner.
Övergripande strukturella egenskaper
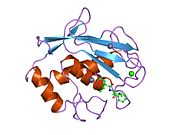
Den katalytiska domänen av MMP-1 är sammansatt av fem kraftigt tvinnade β-strängar (sI-sV), tre α-helix (hA-hC) och totalt åtta slingor, som omsluter totalt fem metalljoner, tre Ca 2+ och två Zn2 + , varav en med katalytisk roll.
Den katalytiska domänen (CAT) av MMP-1 börjar med F100 (icke-trunkerad CAT) som den första aminosyran i den N-terminala slingan i CAT-domänen. Den första publicerade röntgenstrukturen av CAT-domänen var representativ för den trunkerade formen av denna domän, där de första 7 aminosyrorna inte är närvarande.
Efter den initiala slingan följer sekvenserna till det första och längsta β-arket (sI). En andra slinga föregår stor "amfipatisk α-helix" (hA) som längsgående sträcker sig över proteinstället. P-strängarna sII och sIII följer efter åtskilda av respektive slingor, varvid slingan 4 vanligen betecknas som "kort slinga" som överbryggar sII till sIII. Efter sIII-strängen möter sekvensen den "S-formade dubbelslingan" som är av primär betydelse för peptidstrukturen och katalytiska aktiviteten (se vidare) eftersom den sträcker sig till den kluvna sidans "utbuktning" och fortsätter till den enda antiparallella β-strängen sIV, vilket är ytterst viktigt för att binda peptidsubstrat eller inhibitorer genom att bilda vätebindning i huvudkedjan . Efter sIV är loop Gln186-Gly192 och β-sträng sV ansvariga för att bidra med många ligander till de flera metalljoner som finns i proteinet (läs vidare). En stor öppen slinga följer sV som har visat sig vara betydelsefull för substratspecificitet inom MMP-familjen. En specifik region (183)RWTNNFREY(191) har identifierats som ett kritiskt segment av matrismetalloproteinas 1 för uttryck av kollagenolytisk aktivitet. På den C-terminala delen av CAT-domänen omfattar hB α-helixen, känd som "active-site helixen" en del av den "zinkbindande konsensussekvensen" HEXXHXXGXXH som är karakteristisk för Metzincin-superfamiljen. α-helix hB slutar abrupt vid Gly225 där den sista slingan i domänen startar. Denna sista loop innehåller "specificitetsslingan" som är den kortaste i MMP-familjen. Den katalytiska domänen slutar vid Gly261 med α-helix hC.
Fungera
MMP är involverade i nedbrytningen av extracellulär matris i normala fysiologiska processer, såsom embryonal utveckling, reproduktion och vävnadsremodellering, såväl som i sjukdomsprocesser, såsom artrit och metastaser. Specifikt bryter MMP-1 ner de interstitiella kollagenerna , typ I, II och III.

Induktion av matrismetalloproteinas 1 i råtthornhinnor av ciprofloxacin , ofloxacin och levofloxacin (b,c,d) jämfört med konstgjorda tårar (a). Reviglio et al., 2003.
|
förordning
Mekanisk kraft kan öka uttrycket av MMP1 i humana parodontala ligamentceller.
Interaktioner
MMP1 har visats interagera med CD49b .
Vidare läsning
- Krane SM (1995). "Är kollagenas (matrismetalloproteinas-1) nödvändigt för ombyggnad av ben och annan bindväv?". Clin. Orthop. Relat. Res. (313): 47–53. PMID 7641497 .
- Massova I, Kotra LP, Fridman R, Mobashery S (1998). "Matrix metalloproteinaser: strukturer, evolution och diversifiering". FASEB J . 12 (25n26): 1075–95. CiteSeerX 10.1.1.31.3959 . doi : 10.1142/S0217984998001256 . PMID 9737711 .
- Nagase H, Woessner JF (1999). "Matrix metalloproteinaser" . J. Biol. Chem . 274 (31): 21491–4. doi : 10.1074/jbc.274.31.21491 . PMID 10419448 .
- Okada Y, Hashimoto G (2001). "[Nedbrytning av extracellulär matris av matrismetalloproteinaser och ledförstöring]". Seikagaku . 73 (11): 1309–21. PMID 11831026 .
- Seiki M (2003). "Membran-typ 1-matrismetalloproteinas: ett nyckelenzym för tumörinvasion". Cancer Lett . 194 (1): 1–11. doi : 10.1016/S0304-3835(02)00699-7 . PMID 12706853 .
- Golubkov VS, Strongin AY (2007). "Proteolysdriven onkogenes" . Cellcykel . 6 (2): 147–50. doi : 10.4161/cc.6.2.3706 . PMID 17245132 .
externa länkar
- MEROPS onlinedatabas för peptidaser och deras hämmare : M10.001
- Översikt över all strukturell information tillgänglig i PDB för UniProt : P03956 (Interstitiell kollagenas) på PDBe-KB .