Inre tryck
| Termodynamik |
|---|

|
Internt tryck är ett mått på hur den inre energin i ett system förändras när det expanderar eller drar ihop sig vid konstant temperatur . Den har samma dimensioner som tryck , vars SI-enhet är pascal .
Internt tryck ges vanligtvis symbolen . Det definieras som en partiell derivata av intern energi med avseende på volym vid konstant temperatur:
Termodynamisk tillståndsekvation
Internt tryck kan uttryckas i termer av temperatur, tryck och deras ömsesidiga beroende:
Denna ekvation är en av de enklaste termodynamiska ekvationerna . Mer exakt är det en termodynamisk egenskapsrelation, eftersom den gäller för alla system och kopplar tillståndsekvationen till en eller flera termodynamiska energiegenskaper. Här hänvisar vi till det som en "termodynamisk tillståndsekvation."
Härledning av den termodynamiska tillståndsekvationen Den grundläggande termodynamiska ekvationen anger för den exakta differentialen för den interna energin : Att dividera denna ekvation med vid konstant temperatur ger:
Och med en av Maxwell-relationerna : detta ger
Perfekt gas
I en perfekt gas finns det inga potentiella energiinteraktioner mellan partiklarna, så varje förändring i gasens inre energi är direkt proportionell mot förändringen i den kinetiska energin hos dess ingående arter och därför också till förändringen i temperatur:
.
Det inre trycket anses därför vara vid konstant temperatur
, vilket innebär och slutligen ,
dvs den inre energin hos en perfekt gas är oberoende av volymen den upptar. Ovanstående relation kan användas som en definition av en perfekt gas.
Relationen kan bevisas utan att behöva åberopa några molekylära argument. Det följer direkt av den termodynamiska tillståndsekvationen om vi använder den ideala gaslagen . Vi har
Riktiga gaser
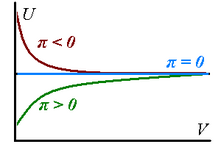
Verkliga gaser har inre tryck som inte är noll eftersom deras inre energi förändras när gaserna expanderar isotermiskt - den kan öka vid expansion ( vilket betyder närvaron av dominerande attraktionskrafter mellan partiklarna av gasen) eller minska ( ,dominant repulsion).
I gränsen för oändlig volym når dessa inre tryck värdet noll:
,
motsvarande det faktum att alla verkliga gaser kan uppskattas vara perfekta inom gränsen för en lagom stor volym. Ovanstående överväganden sammanfattas i grafen till höger.
Om en riktig gas kan beskrivas med van der Waals tillståndsekvation
det följer av den termodynamiska tillståndsekvationen att
Eftersom parametern alltid är positiv, så är även dess inre tryck: den inre energin hos en van der Waals-gas ökar alltid när den expanderar isotermiskt.
Parametern modellerar effekten av attraktionskrafter mellan molekyler i gasen. Men verkliga icke-ideala gaser kan förväntas uppvisa en teckenförändring mellan positiva och negativa inre tryck under rätt miljöförhållanden om avstötande interaktioner blir viktiga, beroende på vilket system som är av intresse. Löst sagt skulle detta tendera att hända under förhållanden så att gasens kompressionsfaktor är större än 1.
Genom användningen av Euler-kedjerelationen kan det dessutom visas att
Definiera Joule koefficient" och känner igen som värmekapaciteten vid konstant volym , vi har
Koefficienten kan erhållas genom att mäta temperaturförändringen för ett konstant- -experiment, dvs. en adiabatisk fri expansion (se nedan). Denna koefficient är ofta liten och vanligtvis negativ vid måttliga tryck (som förutspåtts av van der Waals ekvation).
Joule-experimentet
James Joule försökte mäta det inre lufttrycket i sitt expansionsexperiment genom att adiabatiskt pumpa högtrycksluft från ett metallkärl till ett annat evakuerat. Vattenbadet som systemet var nedsänkt i ändrade inte sin temperatur, vilket betyder att ingen förändring i den inre energin inträffade. Således var luftens inre tryck tydligen lika med noll och luften fungerade som en perfekt gas. det perfekta beteendet observerades inte eftersom de är mycket små och vattnets specifika värmekapacitet är relativt hög.
Peter Atkins och Julio de Paula, Physical Chemistry 8:e upplagan , s. 60–61
- ^ J. Westin, En kurs i termodynamik , volym 1, Taylor och Francis, New York (1979).