IUPAC nomenklatur för oorganisk kemi 2005
Nomenclature of Inorganic Chemistry, IUPAC Recommendations 2005 är 2005 års version av Nomenclature of Inorganic Chemistry (som informellt kallas Red Book ). Det är en samling regler för namngivning av oorganiska föreningar, som rekommenderas av International Union of Pure and Applied Chemistry ( IUPAC).
Sammanfattning
2005 års upplaga ersätter deras tidigare rekommendationer Nomenclature The Red Book of Inorganic Chemistry, IUPAC Recommendations 1990 (Red Book I) och "där det är lämpligt" (sic) Nomenclature of Inorganic Chemistry II, IUPAC Recommendations 2000 (Red Book II) .
Rekommendationerna tar upp över 300 sidor och hela texten kan laddas ner från IUPAC. Rättelser har utfärdats.
Förutom en omorganisation av innehållet finns det ett nytt avsnitt om metallorganiska ämnen och en formell elementlista som ska användas i stället för elektronegativitetslistor vid sekvensering av element i formler och namn. Konceptet med ett föredraget IUPAC-namn (PIN), en del av den reviderade blå boken för namngivning av organiska föreningar, har ännu inte antagits för oorganiska föreningar. Det finns dock riktlinjer för vilken namngivningsmetod som bör användas.
Namngivningsmetoder
Rekommendationerna beskriver ett antal olika sätt på vilka föreningar kan benämnas. Dessa är:
- sammansättningsnamn (t.ex. natriumklorid)
- substitutiv namngivning baserat på moderhydrider (GeCl 2 Me 2 diklordimetylgermane)
- additiv namngivning ([MnFO 3 ] fluoridotrioxidomanganese)
Dessutom finns det rekommendationer för följande:
- namngivning av klusterföreningar
- tillåtna namn för oorganiska syror och derivat
- namngivning av fasta faser, t.ex. icke-stökiometriska faser
För en enkel förening som AlCl 3 ger de olika namnkonventionerna följande:
- sammansättning : aluminiumtriklorid ( stökiometriskt ) eller dialuminiumhexaklorid ( dimer )
- substitution : trikloraluman
- tillsats : trikloridoaluminium; hexakloridodialuminium (dimer utan strukturell information); di-μ-chlorido-tetrachlorido-1κ 2 Cl ,2κ 2 Cl -dialuminium (dimer med strukturell information)
Sekvenseringselement - listan "elektronegativitet".
Genomgående i rekommendationerna har användningen av elements elektronegativitet för sekvensering ersatts av en formell lista som är löst baserad på elektronegativitet. Rekommendationerna använder fortfarande termerna elektropositiv och elektronegativ för att referera till ett elements relativa position i denna lista.
En enkel tumregel som ignorerar lantanider och aktinider är:
- för två element i olika grupper - då har elementet i den högre numrerade gruppen högre "elektronegativitet"
- för två grundämnen inom samma grupp har grundämnet med lägre atomnummer desto högre "elektronegativitet"
- Väte är inpassat för att vara mindre elektronegativt än något kalkogen och mer elektronegativt än något pniktogen. Därför kan formlerna för vatten och ammoniak skrivas H 2 O respektive NH 3 .
Den fullständiga listan, från högsta till lägsta "elektronegativitet" (med tillägg av element 112 till 118, som ännu inte hade namngetts 2005, till sina respektive grupper):
- Grupp 17 i atomnummersekvens dvs F–Ts följt av
- Grupp 16 i atomnummersekvens dvs O–Lv följt av
- H, väte , följt av
- Grupp 15 i atomnummersekvens dvs N–Mc följt av
- Grupp 14 i atomnummersekvens dvs C–Fl följt av
- Grupp 13 i atomnummersekvens dvs B–Nh följt av
- Grupp 12 i atomnummersekvens dvs Zn–Cn följt av
- Grupp 11 i atomnummersekvens dvs Cu–Rg följt av
- Grupp 10 i atomnummersekvens dvs Ni–Ds följt av
- Grupp 9 i atomnummersekvens dvs Co–Mt följt av
- Grupp 8 i atomnummersekvens dvs Fe–Hs följt av
- Grupp 7 i atomnummersekvens dvs Mn–Bh följt av
- Grupp 6 i atomnummersekvens dvs Cr–Sg följt av
- Grupp 5 i atomnummersekvens dvs V–Db följt av
- Grupp 4 i atomnummersekvens dvs Ti–Rf följt av
- Grupp 3 i atomnummersekvens dvs Sc–Y följt av
- lantanoiderna i atomnummersekvens dvs La–Lu följt av
- aktinoiderna i atomnummersekvens dvs Ac–Lr följt av
- Grupp 2 i atomnummersekvens dvs Be–Ra följt av
- Grupp 1 (exklusive H) i atomnummersekvens dvs Li–Fr följt av
- Grupp 18 i atomnummersekvens dvs He–Og
Bestämma den nomenklatur som ska användas
| Handling |
Tillsatsförening ? |
Säker stökiometri? |
monoatomär ? | molekylär ? | metall närvarande? | binda till kol ? |
övergångsmetall grupp 3–12? |
huvudgrupp metallgrupper 1, 2, 3–6? |
|---|---|---|---|---|---|---|---|---|
|
Behandla varje komponent separat, använd sammansättning |
Ja | |||||||
| Använd namngivning av fasta ämnen | Nej | Nej | ||||||
| Namngivning av element eller monoatomisk katjon/anjon/radikal | Nej | Ja | Ja | |||||
|
Dela in komponenter i "elektropositiva"/"elektronegativa" Behandla varje komponent separat Använd generaliserad stökiometrisk namngivning |
Nej | Ja | Nej | Nej | ||||
|
Använd blå bok ( organisk förening ) |
Nej | Ja | Nej | Ja | Nej | Ja | ||
|
Använd additiv namngivning för grupp 3-12 metallorganiska ämnen |
Nej | Ja | Nej | Ja | Ja | Ja | Ja | |
|
Använd substitutnamn för organometalliska ämnen i grupp 3–6 Använd sammansättning för organometalliska ämnen i grupp 1–2 |
Nej | Ja | Nej | Ja | Ja | Ja | Nej | Ja |
| Använd additiv namngivning för koordinationskomplex | Nej | Ja | Nej | Ja | Ja | Nej | Ja | |
| Välj antingen substitut eller additiv | Nej | Ja | Nej | Ja | Nej | Nej |
Notera att "behandla separat" betyder att man använder beslutstabellen för varje komponent
Elementnamn
Prov av obestämd struktur
Ett obestämt urval tar helt enkelt elementnamnet. Till exempel skulle ett prov av kol (som kan vara diamant, grafit etc eller en blandning) benämnas kol.
Specifik allotrop
Molekyl
- O 2 dioxygen (acceptabelt namn oxygen)
- O 3 trioxygen (acceptabelt namn ozon)
- P 4 tetrafosfor (acceptabelt namn vit fosfor)
- S 6 hexasulfur (acceptabelt namn ε-sulfur)
- S 8 cyklo-oktasulfur (acceptabla namn för de polymorfa formerna är α-svavel, β-svavel, γ-svavel)
Kristallin form
Detta specificeras av elementsymbolen följt av Pearson-symbolen för kristallformen. (Observera att rekommendationerna specifikt kursiverar det andra tecknet.)
- C n kol(c F 8) (acceptabelt namn diamant)
- Sn n tenn(t I 4) (acceptabelt namn β- eller vit tenn)
- Mn n mangan(c I 58) (acceptabelt namn α-mangan)
Amorfa erkända allotroper
Exempel inkluderar Pn ,. röd fosfor ; Som n , amorf arsenik.
Föreningar
Kompositionsnamn ger lite strukturell information och rekommenderas för användning när strukturell information inte är tillgänglig eller inte behöver förmedlas. Stökiometriska namn är de enklaste och återspeglar antingen den empiriska formeln eller den molekylära formeln. Ordningen av elementen följer den formella elektronegativitetslistan för binära föreningar och elektronegativitetslistan för att gruppera elementen i två klasser som sedan sekvenseras alfabetiskt. Proportionerna specificeras av di-, tri-, etc. (Se IUPAC numerisk multiplikator . ) Där det är känt att det finns komplexa katjoner eller anjoner namnges dessa i sin egen rätt och sedan används dessa namn som en del av det sammansatta namnet.
Binära föreningar
I binära föreningar placeras det mer elektropositiva elementet först i formeln. Den formella listan används. Namnet på det mest elektronegativa elementet modifieras för att sluta på -ide och namnet på de mer elektropositiva elementen lämnas oförändrat.
Med den binära föreningen av natrium och klor: klor finns först i listan så därför kommer sist i namnet. Andra exempel är
- PCl 5 fosforpentaklorid
- Ca 2 P 3 dikalciumtrifosfid
- NiSn nickelstannid
- Cr23C6 trikosakromhexakarbid _ _ _
Ternära föreningar och vidare
Följande illustrerar principerna.
Den 1:1:1:1 kvartära föreningen mellan brom, klor, jod och fosfor:
- PBrClI fosforbromidkloridjodid (fosfor är den mest elektropositiva, de andra är alla betecknade som elektronegativa och sekvenseras alfabetiskt)
Den ternära 2:1:5-föreningen av antimon, koppar och kalium kan benämnas på två sätt beroende på vilket eller vilka grundämnen som betecknas som elektronegativa.
- CuK 5 Sb 2 kopparpentakaliumdiantimonid, (både koppar och kalium betecknas som elektropositiva och sekvenseras alfabetiskt)
- K 5 CuSb 2 pentakaliumdiantimonid cuprid (endast kalium är betecknat som elektropositivt och de två elektronegativa elementen är sekvenserade alfabetiskt) (Observera att den röda boken visar detta exempel felaktigt)
Namngivning av joner och radikaler
Katjoner
Monatomiska katjoner namnges genom att ta elementnamnet och följa det med laddningen inom parentes t.ex
-
Na +
natrium(1+) -
Cr 3+
krom(3+)
Ibland måste en förkortad form av elementnamnet tas, t.ex. germid för germanium eftersom germanid syftar på GeH
− 3 .
Polyatomära katjoner av samma element benämns som elementnamnet föregås av di-, tri-, etc., t.ex.
-
Hg
2+ 2 dikvicksilver(2+)
Polyatomära katjoner som består av olika element benämns antingen substitutivt eller additivt, t.ex.
-
PH
+ 4 fosfanium -
SbF
+ 4 tetrafluorostibanium (substitutiv) eller tetrafluoridoantimon (1+) - Observera att ammonium och oxonium är acceptabla namn för NH
+ 4 respektive H
3 O +
. (Hydronium är inte ett acceptabelt namn för H
3 O +
[ citat behövs ] )
Anjoner
Monatomiska anjoner benämns som elementet modifierat med en -ide-ändelse. Laddningen står inom parentes, (valfritt för 1−) t.ex.
- Cl − klorid(1−) eller klorid
- S 2− sulfid(2−)
Vissa element tar sitt latinska namn som rot, t.ex
- silver, Ag, argentide
- koppar, Cu, koppar
- järn, Fe, ferride
- tenn, Sn, stannid
Polyatomiska anjoner av samma element benämns som elementnamnet föregås av di-, tri-, etc., t.ex.
- O 2 2− dioxid(2−) (eller peroxid som ett acceptabelt namn)
- C 2 2− dikarbid(2−) (eller acetylid som ett acceptabelt namn)
- S 2 2− disulfid(2−)
eller ibland som ett alternativ härlett från ett substitutnamn t.ex
- S 2 2− disulfandiid
Polyatomiska anjoner som består av olika element benämns antingen substitutivt eller additivt, namnändelserna är -ide respektive -ate, t.ex.
- GeH 3 − germanid (substitutiv) eller trihydridogermanat(1−) (tillsats)
- TeH 3 − tellanuide substitutiv där -uide specificerar anjon som består av ytterligare hydrid fäst till moderhydrid
- [PF 6 ] − hexafluoro-λ 5 -fosfanuid (substitutiv) eller hexafluoridofosfat(1−) (additiv)
- SO 3 2− trioxidosulfat(2−) (tillsats) eller sulfit (acceptabelt icke-systematiskt namn)
En fullständig lista över de alternativa acceptabla icke-systematiska namnen för katjoner och anjoner finns i rekommendationerna. Många anjoner har namn som härrör från oorganiska syror och dessa behandlas senare.
Radikaler
Närvaron av oparade elektroner kan indikeras med ett " · " . Till exempel:
- He · + helium( · +)
- N 2 (2 · )2+ dikväve(2 · 2+)
Namngivning av hydrater och liknande gitterföreningar
Användningen av termen hydrat är fortfarande acceptabel, t.ex. Na2S04 · 10H2O , natriumsulfatdekahydrat . Den rekommenderade metoden skulle vara att namnge det natriumsulfat-vatten (1/10). På liknande sätt andra exempel på gitterföreningar är:
- CaCl 2 · 8NH 3 , kalciumklorid - ammoniak (1/8)
- 2Na 2 CO 3 · 3H 2 O 2 , natriumkarbonat—väteperoxid (2/3)
- AlCl3 · 4EtOH, aluminiumklorid-etanol (1/4)
Ange proportioner med hjälp av laddning eller oxidationstillstånd
Som ett alternativ till di-, tri-prefix kan antingen laddning eller oxidationstillstånd användas. Laddning rekommenderas eftersom oxidationstillståndet kan vara tvetydigt och öppet för debatt.
Substitutiv nomenklatur
Denna namngivningsmetod följer i allmänhet etablerad IUPAC organisk nomenklatur. Hydrider av huvudgruppens element (grupp 13–17) ges -an- basnamn, t.ex. boran, BH 3 . Godtagbara alternativa namn för några av moderhydriderna är vatten snarare än oxidan och ammoniak snarare än azan. I dessa fall är basnamnet avsett att användas för substituerade derivator.
Detta avsnitt av rekommendationerna omfattar namngivning av föreningar som innehåller ringar och kedjor.
Bashydrider
| BH 3 | boran | CH 4 | metan | NH 3 |
azane ( ammoniak ) |
H2O _ _ |
oxidan ( vatten ) |
HF |
fluoran ( vätefluorid ) |
| AlH 3 | aluman | SiH 4 | silan | PH 3 |
fosfan ( fosfin ) |
H 2 S |
sulfan ( vätesulfid eller divätesulfid) |
HCl |
klor ( väteklorid ) |
| GaH 3 | gallane | GeH 4 | tyskt | ASH 3 |
arsane ( arsine ) |
H2Se _ _ |
selan ( väteselenid eller diväteselenid) |
HBr |
broman ( vätebromid ) |
| InH 3 | indigan | SnH 4 | stannane | SbH 3 |
stibane ( stibine ) |
H 2 Te |
tellan ( vätetellurid eller divätetellurid) |
HEJ |
jodan ( vätejodid ) |
| TlH 3 | thallane | PbH 4 | plumbane | BiH 3 |
vismutan ( vismutin ) |
H 2 Po |
polan ( vätepolonid eller divätepolonid) |
Hatt |
astatan ( väteastatid ) |
Hydrider med icke-standardbindning – lambdakonvention
När en förening har icke-standardbindning jämfört med moderhydriden, till exempel PCl5, används lambdakonventionen. Till exempel:
- PCl5 pentaklor -A5 - fosfan
- SF6 - hexafluor-A6 - sulfan
Polynukleära hydrider
Ett prefix di-, tri- etc. läggs till det överordnade hydridnamnet. Exempel är:
- HOOH, dioxidan (väteperoxid är ett acceptabelt namn)
- H2PPH2 , difosfan _ _
- H3SiH2SiH2SiH3 , tetrasilan _ _ _ _ _ _
Ringar och kedjor
Rekommendationerna beskriver tre sätt att tilldela "förälder" namn till homonukleära monocykliska hydrider (dvs enkla ringar som består av ett element):
- Hantzsch –Widman-nomenklaturen (den metod som föredras för ringar i storlek 3–10)
- "skelettersättningsnomenklatur" – specificerar ersättningen av kolatomer i motsvarande kolförening med atomer av ett annat grundämne (t.ex. kisel blir sila, germanium, germa) och ett multiplikativt prefix tri, tetra, penta etc) (den metod som föredras för ringar större än 10)
- genom att lägga till prefixet cyclo till namnet på motsvarande ogrenade, osubstituerade kedja
Borhydrider
Det stökiometriska namnet följs av antalet väteatomer inom parentes. Till exempel B2H6 , diboran(6 ) . Mer strukturell information kan förmedlas genom att lägga till prefixen "strukturell deskriptor" closo -, nido -, arachno -, hypho -, klado -. Det finns en helt systematisk metod för att numrera atomerna i borhydridklustren och en metod för att beskriva positionen för överbryggande väteatomer med hjälp av μ-symbolen.
Huvudgrupp organometalliska föreningar
Användning av substitutiv nomenklatur rekommenderas för organometalliska föreningar i huvudgruppen 13–16. Exempel är:
- AlH2Me benämnd metylaluman
- BiI 2 Ph benämnd dijod(fenyl)bismutan
För metallorganiska föreningar i grupperna 1–2 kan man använda tillsats (som indikerar ett molekylärt aggregat) eller sammansättningsnamn. Exempel är:
- [BeEtH] benämnd etylhydridoberyllium eller etanidohydridoberyllium
- [Mg(η5 - C5H5 ) 2 ] benämnd bis( η5 -cyklopentadienyl)magnesium, eller bis(η5 - cyklopentadienido )magnesium
- Na(CHCH 2 ) natriumetenid (sammansättningsnamn)
Rekommendationen noterar dock att framtida nomenklaturprojekt kommer att ta upp dessa föreningar.
Additiv nomenklatur
Detta namn har utvecklats huvudsakligen för koordinationsföreningar även om det kan tillämpas mer allmänt. Exempel är:
- Si(OH) 4- tetrahydroxidkisel (tillsats) eller silanetetrol (substitutiv) (observera att kiselsyra är ett acceptabelt namn – ortosilicic har tagits bort).
- [CoCl(NH3 ) 5 ] Cl2 - pentaaminkloridokobalt(2+)klorid
Rekommenderad procedur för att namnge mononukleära föreningar
Rekommendationerna inkluderar ett flödesschema som kan sammanfattas mycket kort:
- identifiera den centrala atomen,
- identifiera och namnge liganderna,
- specificera koordinationssätt för ligander, dvs med kappa- och/eller eta-konventioner
- sekvensera liganderna
- specificera koordinationsgeometri, dvs polyedrisk symbol, konfigurationsindex (med CIP-regler och absolut konfiguration för optiskt aktiva föreningar.
Ligandnamn
Anjoniska ligander
Om anjonnamnet slutar på -ide ändras dess namn som ligand till att sluta på -o. Till exempel blir kloridanjonen, Cl − klorid. Detta är en skillnad från namngivning av organisk förening och substitutiv namngivning där klor behandlas som neutralt och det blir klor, som i PCl 3 , som kan benämnas antingen substitutivt eller additivt som triklorfosfan respektive trikloridfosfor.
På liknande sätt om anjonnamnen slutar på -ite, -ate så är ligandnamnen -ito, -ato.
Neutrala ligander
Neutrala ligander byter inte namn med undantag för följande:
- Vatten, "aqua"
- Ammoniak, "amin"
- Kolmonoxid bunden via kol, "karbonyl"
- Kvävemonoxid bunden via kväve, "nitrosyl"
Exempel på ligandnamn
| Formel | namn |
|---|---|
| Cl- _ | klorido |
| CN − | cyanido |
| H − | hydrido |
| D - eller 2 H - | deuterido eller [ 2H ]hydrido |
| PhCH 2 CH 2 Se − | 2-fenyletan-1-selenolato |
| MeCOO − | acetat eller etanoato |
| Me 2 As − | dimetylarsanido |
| MePH − | metylfosfanido |
| MeCONH 2 | acetamid (ej acetamido) |
| MeCONH − | acetylazanido eller acetylamido (ej acetamido) |
| MeNH 2 | metanamin |
| MeNH − | metylazanido, eller metylamido, eller metanaminido |
| MePH 2 | metylfosfan |
| CO | karbonyl |
Sekvens och position för ligander och centrala atomer
Ligander är ordnade alfabetiskt efter namn och föregår det centrala atomnamnet. Antalet ligander som koordinerar indikeras av prefixen di-, tri-, tetra-penta- etc. för enkla ligander eller bis-, tris-, tetrakis- etc. för komplexa ligander. Till exempel:
- [CoCl(NH3 ) 5 ] Cl2 - pentaaminkloridokobalt(3+)klorid där amin (NH3) föregår klorid. De centrala atomnamnen kommer efter liganderna. Där det finns mer än en central atom föregås den av di- tri-, tetra- etc.
- Os3 (CO) 12 , dodekakarbonyltriosmium
Där det finns olika centrala atomer sekvenseras de med hjälp av elektronegativitetslistan.
- [ReCo(CO) 9 ] nonakarbonylreniumkobolt
Överbryggande ligander – användning av μ-symbol
Ligander kan överbrygga två eller flera centra. Prefixet μ används för att specificera en överbryggande ligand i både formeln och namnet. Till exempel den dimera formen av aluminiumtriklorid :
- Al 2 Cl 4 (μ-Cl) 2
- di-μ-klorido-tetraklorid-1κ 2 Cl ,2κ 2 Cl -dialuminium
Detta exempel illustrerar ordningen av bryggbildande och icke bryggbildande ligander av samma typ. I formeln följer de överbryggande liganderna de icke-bryggande medan de i namnet de överbryggande liganderna föregår de icke-bryggande. Notera användningen av kappakonventionen för att specificera att det finns två terminala klorider på varje aluminium.
Överbryggande index
Om det finns fler än två centra som är överbryggade läggs ett bryggindex till som ett abonnemang. Till exempel i basiskt berylliumacetat som kan visualiseras som ett tetraedriskt arrangemang av Be-atomer kopplade av 6 acetatjoner som bildar en bur med en central oxidanjon, är formeln och namnet följande:
- [Be 4 (μ 4 -O)(μ-O 2 CMe) 6 ]
- hexakis(μ-acetato-κ O :κ O ′)-μ 4 -oxido- tetrahedro -tetraberyllium
μ 4 beskriver bryggbildningen av den centrala oxidjonen. (Notera användningen av kappakonventionen för att beskriva bryggbildningen av acetatjonen där båda syreatomerna är inblandade.) I namnet där en ligand är involverad i olika sätt att brygga, listas den multipla bryggbildningen i fallande ordning av komplexitet, t.ex. μ 3 bryggning före μ 2 bryggning.
Kappa, K, konvention
Kappakonventionen används för att specificera vilka ligandatomer som binder till den centrala atomen och i polynukleära arter vilka atomer, både bryggade och obryggade, länkar till vilken central atom. För monodentate ligander finns det ingen tvetydighet om vilken atom som bildar bindningen till den centrala atomen. Men när en ligand har mer än en atom som kan länka till en central atom används kappakonventionen för att specificera vilka atomer i en ligand som bildar en bindning. Elementets atomsymbol är kursiverad och föregås av kappa, κ. Dessa symboler placeras efter den del av ligandnamnet som representerar ringen, kedjan etc där liganden finns. Till exempel:
- pentaamminenitrito-K O -kobolt(III) specificerar att nitritliganden länkas via syreatomen
När det finns mer än en bindning bildad från en ligand av ett visst element ger en numerisk upphöjd räkningen. Till exempel:
- aqua[(etan-1,2-diyldinitrilo-κ 2 N , N ')tris(acetato-κ O )acetato]koboltat(1-), koboltanjonen bildad med vatten och pentadentat edta , som länkas via två kväveatomer och tre syreatomer. Det finns två bindningar från kväveatomer i edta som specificeras av -K 2 N , N '. De tre bindningarna från syre specificeras av tris(acetato-K O ), där det finns en ligering per acetat.
I polynukleära komplex utökas användningen av kappa-symbolen på två relaterade sätt. För det första att specificera vilka ligerande atomer som binder till vilken central atom och för det andra att specificera för en överbryggande ligand vilka centrala atomer som är inblandade. De centrala atomerna måste identifieras, dvs genom att tilldela dem nummer. (Detta behandlas formellt i rekommendationerna). För att specificera vilka ligerande atomer i en ligand som länkar till vilken central atom, står de centrala atomnumren före kappa-symbolen, och numeriskt upphöjt anger antalet ligationer och detta följs av atomsymbolen. Flera förekomster separeras med kommatecken.
Exempel:
- di-μ-klorido-tetraklorid-1κ 2 Cl, 2κ 2 Cl-dialuminium, ( aluminiumtriklorid) .
- tetrachlorido-1K 2 Cl, 2K 2 Cl anger att det finns två kloridligander på varje aluminiumatom.
- dekakarbonyl-1K3C , 2K3C , 3K4C - di -μ-hydrido-1:2K2H ; 1 : 2K2H - triangulo- ( 3 Os — Os ), ( Dekakarbonyldihydridotriosmium ) .
- dekakarbonyl-1K 3 C , 2 K 3 C , 3 K 4 C visar att det finns tre karbonylgrupper på två osmiumatomer och fyra på den tredje.
- di-μ-hydrido-1:2κ 2 H ;1:2κ 2 H anger att de två hydridbryggorna mellan osmiumatom 1 och osmiumatom 2.
Eta, η, konvention
Användningen av η för att beteckna hapticity systematiseras. Användning av η 1 rekommenderas inte. När specifikationen av de inblandade atomerna är tvetydig måste atomernas position specificeras. Detta illustreras av exemplen:
- Cr(η 6 -C 6 H 6 ) 2 , benämnd bis(η 6 -bensen) krom eftersom alla (angränsande) atomer i bensenliganderna är involverade, behöver deras position inte specificeras
- [(1,2,5,6-η)-cyklookta-1,3,5,7-tetraen](η5- cyklopentadienyl )kobolt i denna endast två (i positionerna 1 och 5) av de fyra dubbelbindningarna är sammanlänkade till centralatomen.
Koordinationsgeometri
För alla koordinationsnummer över 2 är mer än en koordinationsgeometri möjlig. Till exempel kan fyra koordinatkoordinationsföreningar vara tetraedriska, kvadratiska plana, kvadratiska pyramidformade eller gungsågsformade. Den polyedriska symbolen används för att beskriva geometrin. Ett konfigurationsindex bestäms från positionerna för liganderna och placeras tillsammans med den polyedriska symbolen i början av namnet. Till exempel i komplexet ( SP -4-3)-(acetonitril)diklorido(pyridin)platina(II) beskriver ( SP -4-3) i början av namnet en kvadratisk plan geometri, 4 koordinat med ett konfigurationsindex av 3 indikerar positionen för liganderna runt den centrala atomen. För mer detaljer se polyedrisk symbol .
Organometalliska grupper 3–12
Additiv nomenklatur rekommenderas generellt för organometalliska föreningar i grupperna 3-12 (övergångsmetaller och zink, kadmium och kvicksilver).
Metallocener
Efter ferrocen - den första sandwichföreningen med en central Fe-atom koordinerad till två parallella cyklopentadienylringar - är namn på föreningar med liknande strukturer som osmocen och vanadocen i vanligt bruk. Rekommendationen är att den namnslutande ocenen bör begränsas till föreningar där det finns diskreta molekyler av bis(η 5 -cyklopentadienyl)metall (och ringsubstituerade analoger), där cyklopentadienylringarna är väsentligen parallella och metallen finns i d-block. Terminologin gäller INTE föreningar av s- eller p-blockelementen såsom Ba(C 5 H 5 ) 2 eller Sn(C 5 H 5 ) 2 .
Exempel på föreningar som uppfyller kriterierna är:
- vanadocen , [ V( ri5 - C5H5 ) 2 ]
- kromocen , [ Cr( r5 - C5H5 ) 2 ]
- koboltocen , [ Co( r5 - C5H5 ) 2 ]
- rhodocen , [ Rh( r5 - C5H5 ) 2 ]
- nickelocen , [ Ni( r5 - C5H5 ) 2 ]
- rutenocen , [Ru ( r5 - C5H5 ) 2 ]
- osmocen , [ Os( r5 - C5H5 ) 2 ]
- manganocen , [ Mn( r5 - C5H5 ) 2 ]
- renocen , [Re( ri5 - C5H5 ) 2 ] .
Exempel på föreningar som inte bör benämnas metallocener är:
- C10H10Ti _ _ _ _
- [Ti(η 5 -C 5 H 5 ) 2 Cl 2 ] benämns korrekt dikloridobis(η 5 -cyklopentadienyl) titan INTE titanocen diklorid
Polynukleära klusterföreningar
Metall-metallbindningar
I polynukleära föreningar med metall-metallbindningar visas dessa efter elementnamnet enligt följande: (3 Os — Os ) i Decacarbonyldihydridotriosmium . Ett par parenteser innehåller ett antal av de bildade bindningarna (om de är större än 1), följt av de kursiverade elementets atomsymboler åtskilda av ett "em-streck".
Polynukleär klustergeometri
Geometrierna för polynukleära kluster kan variera i komplexitet. En deskriptor t.ex. tetrahedro eller CEP-deskriptorn t.ex. Td- (13)-A4 - closo ] kan användas. detta bestäms av klustrets komplexitet. Nedan visas några exempel på deskriptorer och CEP-ekvivalenter. (CEP-beskrivningarna är uppkallade efter Casey, Evans och Powell som beskrev systemet.
| antal atomer | deskriptor | CEP-beskrivning |
|---|---|---|
| 3 | triangulo | |
| 4 | quadro | |
| 4 | tetraeder | [ Td- (13) -A4 - closo ] |
| 5 | [ D3h- ] (131 ) -A6 - closo | |
| 6 | oktaeder | [ Oh- ] (141 ) -A8 - closo |
| 6 | triprismo | |
| 8 | antiprismo | |
| 8 | dodekaeder | [ D2d- ] (2222 ) -A6 - closo |
| 12 | icosahedro | [ Ih- ] (1551 ) -A20 - closo |
Exempel:
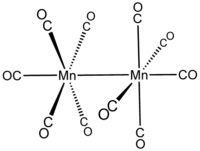 dekakarbonyldimangan bis(pentakarbonylmangan)( Mn — Mn )
dekakarbonyldimangan bis(pentakarbonylmangan)( Mn — Mn )
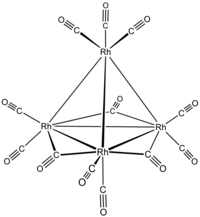
dodekakarbonyltetrarhodium tri-μ-karbonyl-1:2k 2 C ;1:3k 2 C ;2:3k 2 C -nonakarbonyl- 1k 2 C ,2k 2 C ,3k 2 C , 4k 3 C -[ Td -(13) -Δ4 - closo ] -tetrarhodium(6 Rh — Rh ) eller tri-μ-karbonyl-1:2k2C ; 1 : 3k2C ; 2: 3k2C - nonakarbonyl - 1k2C , 2k2C , 3k 2 C ,4K 3C - tetrahedro -tetrarhodium(6 Rh — Rh )
Oorganiska syror
Vätgasnamn
Rekommendationerna inkluderar en beskrivning av vätenamn för syror. Följande exempel illustrerar metoden:
- HNO 3 väte (nitrat)
- H 2 SO 4 diväte(sulfat)
- HSO − 4 väte(sulfat) (2−)
- H 2 S diväte (sulfid)
Observera att skillnaden från den sammansatta namngivningsmetoden (vätesulfid) som vid namngivning av väte, det finns INGET utrymme mellan de elektropositiva och elektronegativa komponenterna.
Denna metod ger ingen strukturell information om läget för hydronerna (väteatomerna). Om denna information ska förmedlas ska tillsatsnamnet användas (se listan nedan för exempel).
Lista över godtagbara namn
Rekommendationerna ger en fullständig lista över acceptabla namn för vanliga syror och relaterade anjoner. Ett urval från denna lista visas nedan.
| syra acceptabelt namn |
relaterade anjoner - acceptabla namn och tillsatsnamn |
||
|---|---|---|---|
| borsyra , [B(OH) 3 ] |
diväteborat, [BO(OH) 2 ] - dihydroxidooxidoborat(1—) |
väteborat, [BO 2 (OH)] 2 − hydroxidodioxidborat(2—) |
borat, [BO 3 ] 3 - trioxidoborat(3—) |
| kolsyra , [CO(OH) 2 ] |
vätekarbonat, [CO 2 (OH)] − hydroxidodioxidkarbonat(1−) |
karbonat, [CO 3 ] 2 − trioxidokarbonat(2−) |
|
|
klorsyra , [ClO2 ( OH)] hydroxidodioxidklor |
klorat, [ClO 3 ] − trioxidoklorat(1−) |
||
|
klorsyra , [ClO(OH)] hydroxidoxidoklor |
klorit, [ClO 2 ] − dioxidklorat(1−) |
||
|
salpetersyra , [NO 2 (OH)] hydroxidodioxidonitrogen |
nitrat, [NO − 3 ] trioxidonitrat(1−) |
||
|
salpetersyrlighet , [NO(OH)] hydroxidoxidonitrogen |
nitrit, [NO 2 ] − dioxidonitrat(1−) |
||
|
perklorsyra , [ClO3 ( OH)] hydroxidotrioxidoklor |
perklorat, [ClO 4 ] − tetraoxidoklorat(1−) |
||
|
fosforsyra , [PO(OH) 3 ] trihydroxidooxidofosfor |
divätefosfat, [PO 2 (OH) 2 ] − dihydroxidodioxidofosfat(1−) |
vätefosfat, [PO 3 (OH)] 2 − hydroxidotrioxidofosfat(2−) |
fosfat, [PO 4 ] 3 − tetraoxidofosfat(3—) |
|
fosfonsyra , [PHO(OH) 2 ] hydridodihydroxidooxidofosfor |
vätefosfonat, [PHO 2 (OH)] − hydridohydroxidodioxidofosfat(1−) |
fosfonat, [PHO 3 ] 2 − hydridotrioxidofosfat(2−) |
|
|
fosforsyra , H3PO3 trihydroxidofosfor _ _ |
divätefosfit [PO(OH) 2 ] − dihydroxidooxidofosfat(1−)) | vätefosfit, [PO 2 (OH)] 2 − hydroxidodioxidfosfat(2−) |
fosfit, [PO 3 ] 3 − trioxidofosfat(3−) |
|
svavelsyra, [SO 2 (OH) 2 ] dihydroxidodioxidosvavel |
vätesulfat, [SO 3 (OH)] − hydroxidotrioxidosulfat(1−) |
sulfat, [SO 4 ] 2 − tetraoxidosulfat(2−) |
|
Fasta ämnen
Stökiometriska faser benämns kompositionsmässigt. Icke-stökiometriska faser är svårare. Om möjligt bör formler användas men vid behov kan namngivning som följande användas:
- järn(II)sulfid (järnbrist)
- molybdendikarbid (kolöverskott)
Mineralnamn
Mineralnamn bör i allmänhet inte användas för att specificera kemisk sammansättning. Ett mineralnamn kan dock användas för att specificera strukturtypen i en formel, t.ex
- BaTiO 3 (typ perovskite)
Ungefärliga formler och variabel sammansättning
En enkel notation kan användas där lite information om mekanismen för variabilitet antingen är tillgänglig eller inte behöver förmedlas:
- ~ FeS (cirka eller ungefär)
Där det finns ett kontinuerligt intervall av sammansättning kan detta skrivas t.ex. K(Br,Cl) för Li2 ,Mg)Cl2 för en blandning av KBr och KCl och MgCl2 ( en blandning av LiCl och . Rekommendationen är att använda följande generaliserade metod, t.ex
- Cu x Ni 1-x för (Cu,Ni)
- KBr x Cl 1-x för K(Br,Cl)
Observera att lediga katjoner i CoO kan beskrivas av CoO 1-x
Punktdefekter (Kröger–Vink) notation
Punktdefekter, platssymmetri och platsbeläggning kan alla beskrivas med Kröger–Vink-notation , observera att IUPAC-preferensen är att vakanser specificeras av V snarare än V (elementet vanadin).
Fasnomenklatur
För att specificera kristallformen för en förening eller ett element kan Pearson-symbolen användas. Användningen av Strukturbericht (t.ex. A1 etc) eller grekiska bokstäver är inte acceptabel. Pearson-symbolen kan följas av rymdgruppen och prototypformeln. Exempel är:
- kol(cF8 ) , diamant
- RuAl (C P2 2, Pm3m)( CsCl- typ)
Polymorfism
Det rekommenderas att polymorfer identifieras (t.ex. för ZnS där de två formerna zincblende (kubisk) och wurtzite (hexagonal)), som ZnS( c ) respektive ZnS( h ) .
