CA1 (gen)
| CA1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , CA-I, CAB, Car1, HEL-S-11, kolsyraanhydras 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID :n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Kolsyraanhydras 1 är ett enzym som hos människor kodas av CA1 -genen .
Kolsyraanhydraser (CA) är en stor familj av zinkmetalloenzymer som katalyserar den reversibla hydreringen av koldioxid . De deltar i en mängd olika biologiska processer, inklusive cellandning , förkalkning , syra-basbalans, benresorption och bildandet av vattenhaltig vätska, cerebrospinalvätska , saliv och magsyra .
De visar omfattande mångfald i vävnadsfördelning och i deras subcellulära lokalisering. CA1 är nära kopplat till CA2- och CA3-gener på kromosom 8 , och det kodar för ett cytosoliskt protein som finns på den högsta nivån i erytrocyter . Transkriptionsvarianter av CA1 som använder alternativa polyA_sites har beskrivits i litteraturen.
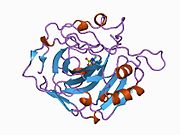
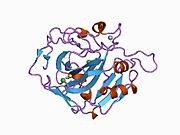
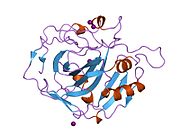
Strukturera
aktivt ställe med N-terminal, zinkbindningsställe och substratbindningsställe. Kristallstrukturen hos det mänskliga CA1- bikarbonatanjonkomplexet avslöjar geometrin hos två H-bindningar mellan Glu 106- Thr 199-paret och Glu117 -His 119-paret , och en pi H-bindning mellan en vattenmolekyl och fenylringen i Tyr 114 - resten. Produktinhiberingen av CA1 via bikarbonatanjoner är korrelerad till protonlokaliseringsförändringen på His119 . Så Glu117-His119 H-bindningen anses reglera joniciteten hos zinkjonen och bindningsstyrkan hos bikarbonatanjonen.
Mekanism
Reaktionen som katalyseras av CA1 är densamma som andra proteiner från kolsyraanhydrasfamiljen:
(i vävnader - hög CO 2 koncentration)
Den CA1-katalyserade reaktionen har en relativt låg reaktionsaffinitet (Km) på 4,0 mM för CO 2 , omsättningstal (Kcat) på 2 × 10 5 s −1 och katalytisk effektivitet (Kcat/Km) på 5 × 10 7 M − 1 s −1 jämfört med andra isozymer i α-CA-familjen av kolsyraanhydraser. Omsättningshastigheten och den katalytiska hastigheten för CA1 är endast cirka 10 % av CA2 (Kcat: 1,4 × 10 6 s −1 , Kcat/Km: 1,5 × 10 8 M −1 s −1 ).
Fungera
Kolsyraanhydras 1 tillhör α-CA-underfamiljen och är lokaliserad i cytosolen av röda blodkroppar , mag-tarmkanalen , hjärtvävnader och andra organ eller vävnader. Transmembrantransport av CA-producerat bikarbonat bidrar väsentligt till cellulär pH -reglering.
I en human zinkaktiverad variant av CA1, Michigan-varianten, ändrar en enda punktmutation His 67 till Arg i en kritisk region av det aktiva stället. Denna variant av zinkmetalloenzymet verkar vara unik genom att den har esterasaktivitet som specifikt förstärks av tillsatta fria zinkjoner.
Klinisk signifikans
CA1-aktivering är associerad med försämrad patologisk ombyggnad vid human ischemisk diabetisk kardiomyopati . Hos patienter med diabetes mellitus typ 2 med postinfarkt hjärtsvikt som genomgick kirurgisk koronar revaskularisering , var myokardnivåerna av CA1 sex gånger högre än hos icke-diabetespatienter. Förhöjt CA1-uttryck var huvudsakligen lokaliserat i hjärtinterstitium och endotelceller . Dessutom hämmar hög glukosinducerad höjning av CA1 endotelcellpermeabilitet och bestämmer endotelcellapoptos in vitro .
CA1 förmedlar också hemorragisk retinal och cerebral vaskulär permeabilitet genom prekallikreinaktivering och generering av serinproteasfaktor XIIa . Dessa fenomen inducerar proliferativ diabetisk retinopati och diabetisk makulaödem sjukdomsprogression , som representerar ledande orsaker till synförlust.
Eftersom CA1 är ett viktigt terapeutiskt mål kommer utvecklingen av dess inhibitorer att bidra till sjukdomsbehandling. Jämfört med andra CA-familjemedlemmar har CA1 relativt låg affinitet till vanliga CA-hämmare. Icke desto mindre har den medium affinitet för CA-hämmare sulfonamider . [ citat behövs ]
Interaktioner
CA1 har visat sig interagera med:
Dessa interaktioner har bekräftats med hög genomströmningsmetoden (en träff)
externa länkar
- Mänskligt CA1- genomplacering och CA1- geninformationssida i UCSC Genome Browser .
Vidare läsning
- Tashian RE, Carter ND (1977). "Biokemisk genetik av kolsyraanhydras". Framsteg inom mänsklig genetik . 7 : 1–56. doi : 10.1007/978-1-4757-0659-8_1 . ISBN 978-1-4757-0661-1 . PMID 827930 .
- Sly WS, Hu PY (1995). "Humana kolanhydraser och kolsyraanhydrasbrister". Årlig översyn av biokemi . 64 (1): 375–401. doi : 10.1146/annurev.bi.64.070195.002111 . PMID 7574487 .
- Kendall AG, Tashian RE (juli 1977). "Erytrocyt kolanhydras I: ärftlig brist hos människor". Vetenskap . 197 (4302): 471–2. Bibcode : 1977Sci...197..471K . doi : 10.1126/science.406674 . PMID 406674 .
- Kannan KK, Notstrand B, Fridborg K, Lövgren S, Ohlsson A, Petef M (Jan 1975). "Kristallstruktur av humant erytrocyt-karboanhydras B. Tredimensionell struktur med en nominell 2,2-A-upplösning" ( PDF) . Proceedings of the National Academy of Sciences of the United States of America . 72 (1): 51–5. doi : 10.1073/pnas.72.1.51 . PMC 432238 . PMID 804171 .
- Dawson SJ, White LA (maj 1992). "Behandling av Haemophilus aphrophilus endokardit med ciprofloxacin". The Journal of Infection . 24 (3): 317–20. doi : 10.1016/S0163-4453(05)80037-4 . PMID 1602151 .
- Lowe N, Brady HJ, Barlow JH, Sowden JC, Edwards M, Butterworth PH (sep 1990). "Struktur och metyleringsmönster för genen som kodar för humant kolanhydras I". Gene . 93 (2): 277–83. doi : 10.1016/0378-1119(90)90236-K . PMID 2121614 .
- Noda Y, Sumitomo S, Hikosaka N, Mori M (april 1986). "Immunhistokemiska observationer av kolsyraanhydras I och II i mänskliga spottkörtlar och submandibulär obstruktiv adenit". Journal of Oral Pathology . 15 (4): 187–90. doi : 10.1111/j.1600-0714.1986.tb00604.x . PMID 3088232 .
- Barlow JH, Lowe N, Edwards YH, Butterworth PH (mars 1987). "Humant kolsyraanhydras I cDNA" . Nukleinsyraforskning . 15 (5): 2386. doi : 10.1093/nar/15.5.2386 . PMC 340641 . PMID 3104879 .
- Edwards YH, Barlow JH, Konialis CP, Povey S, Butterworth PH (maj 1986). "Tilldelning av genen som bestämmer humant kolanhydras, CAI, till kromosom 8". Annals of Human Genetics . 50 (Pt 2): 123–9. doi : 10.1111/j.1469-1809.1986.tb01030.x . PMID 3124707 . S2CID 44919686 .
- Lin KT, Deutsch HF (april 1974). "Humana kolanhydraser. XII. Den fullständiga primära strukturen av C-isozymet" . Journal of Biological Chemistry . 249 (8): 2329–37. doi : 10.1016/S0021-9258(19)42734-8 . PMID 4207120 .
- Giraud N, Marriq C, Laurent-Tabusse G (1975). "[Primärstruktur av humant B-erytrocyt-karboanhydras. 3. Sekvens av CNBr-fragment I och III (rester 149-260)]". Biochimie . 56 (8): 1031–43. doi : 10.1016/S0300-9084(74)80093-3 . PMID 4217196 .
- Andersson B, Nyman PO, Strid L (aug 1972). "Aminosyrasekvens av human erytrocyt kolanhydras B". Biokemisk och biofysisk forskningskommunikation . 48 (3): 670–7. doi : 10.1016/0006-291X(72)90400-7 . PMID 4625868 .
- Lin KT, Deutsch HF (mars 1973). "Humana kolsyraanhydraser. XI. Den fullständiga primära strukturen av kolsyraanhydras B" . Journal of Biological Chemistry . 248 (6): 1885–93. doi : 10.1016/S0021-9258(19)44161-6 . PMID 4632246 .
- Omoto K, Ueda S, Goriki K, Takahashi N, Misawa S, Pagaran IG (januari 1981). "Befolkningsgenetiska studier av filippinska Negritos. III. Identifiering av kolsyraanhydras-1-varianten med CA1 Guam" . American Journal of Human Genetics . 33 (1): 105–11. PMC 1684865 . PMID 6781336 .
- Chegwidden WR, Wagner LE, Venta PJ, Bergenhem NC, Yu YS, Tashian RE (1995). "Markerad zinkaktivering av esterhydrolys genom en mutation, 67-His (CAT) till Arg (CGT), i det aktiva stället för humant kolanhydras I". Mänsklig mutation . 4 (4): 294–6. doi : 10.1002/humu.1380040411 . PMID 7866410 . S2CID 21458184 .
- Bekku S, Mochizuki H, Takayama E, Shinomiya N, Fukamachi H, Ichinose M, Tadakuma T, Yamamoto T (dec 1998). "Kolsyraanhydras I och II som en differentieringsmarkör för kolon enterocyter från människa och råtta". Forskning inom experimentell medicin. Zeitschrift für die Gesamte Experimentelle Medizin Einschliesslich Experimenteller Chirurgie . 198 (4): 175–85. doi : 10.1007/s004330050101 . PMID 9879596 . S2CID 11297322 .
- Puscas I, Coltau M, Baican M, Pasca R, Domuta G, Hecht A (2001). "Vasokonstriktiva läkemedel ökar kolsyraanhydras I i vaskulär glatt muskulatur medan vasodilaterande läkemedel minskar aktiviteten av detta isozym genom en direkt verkningsmekanism". Läkemedel under experimentell och klinisk forskning . 27 (2): 53–60. PMID 11392054 .






![{\displaystyle {\ce {{CO2}+H2O->[{} \atop {\ce {Carbonic~anhydrase}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dc04cbaad8785a9a141ee4bcf2beaca7d736863)