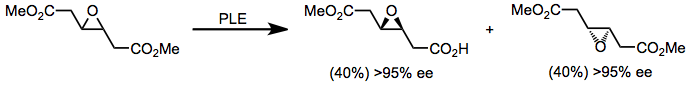Asymmetrisk esterhydrolys med grisleveresteras
Asymmetrisk esterhydrolys med grisleveresteras är den enantioselektiva omvandlingen av en ester till en karboxylsyra genom inverkan av enzymet grisleveresteras (EC 3.1.1.1) . Asymmetrisk esterhydrolys involverar selektiv reaktion av en av ett par av antingen enantiotopiska (inom samma molekyl och besläktade med ett symmetriplan av molekylen) eller enantiomorfa (i enantiomera molekyler och besläktade som spegelbilder) estergrupper.
Introduktion
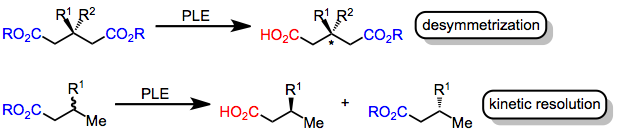
Enzymer, som är sammansatta av kirala aminosyror , katalyserar kemiska reaktioner med hög stereoselektivitet . Specifikt katalyserar esterasenzymer hydrolysen av estrar till karboxylsyror . Denna transformation kan göras asymmetrisk om två enantiotopiska estergrupper existerar i substratet eller om en racemisk blandning av kirala estrar används. I det förra fallet ( desymmetrisering ) leder den kirala miljön för det enzymaktiva stället till selektiv hydrolys av estern som är närmare den katalytiskt aktiva serinresten när substratet är bundet till enzymet. I det senare fallet ( kinetisk upplösning ) hydrolyseras en av enantiomererna snabbare än den andra, vilket leder till ett överskott av hydrolyserad produkt från en enantiomer. Båda strategierna förlitar sig på det faktum att övergångstillstånden för hydrolys av enantiotopiska eller enantiomorfa estergrupper av det kirala enzymet är diastereomera .
Grisleveresteras (PLE) är ett mycket använt enzym för asymmetrisk esterhydrolys. Även om det ursprungligen användes för desymmetriserande hydrolys av glutaratestrar, hydrolyserar PLE också malonater , cykliska diestrar, monoestrar och andra substrat. Aktiva platsmodeller har utvecklats för att förklara selektiviteten hos PLE.
(1)
Mekanism och stereokemi
Rådande mekanism
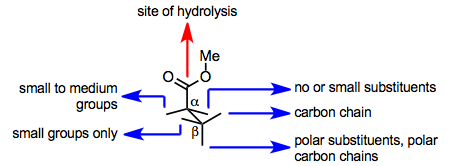
Det aktiva stället för PLE underlättar både substratbindning och hydrolys. En nyckelserinrest på det aktiva stället främjar hydrolys, men substratet måste presentera en estergrupp till denna rest efter bindning till det aktiva enzymet för att hydrolys ska äga rum. Huruvida substratet kan presentera en estergrupp till den katalytiska serinresten beror på dess bundna konformation i det aktiva stället, vilket dikteras av aminosyrasidokedjor i det aktiva stället. Således har aktiva ställemodeller av PLE utvecklats med målet att förutsäga från strukturen av substratet vilken av två enantiotopiska estergrupper som kommer att hydrolyseras (eller om hydrolys är troligt att inträffa överhuvudtaget).
En enkel modell för bindningskonformationen av en ester i det aktiva stället för PLE visas nedan. Denna modell förutsäger exakt konfigurationen av hydrolyserade glutarater och liknande substrat.
(2)
Omfattning och begränsningar
Även om substratomfånget för PLE är brett, varierar enantioselektiviteten som en funktion av substratets struktur. Detta avsnitt beskriver substrat som hydrolyseras av PLE med den högsta enantioselektiviteten, såväl som känsliga substrat som kan hydrolyseras till akirala karboxylsyror i högt utbyte utan sidoreaktioner.
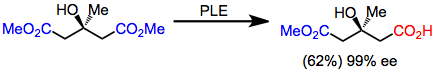
Glutarater var de första substraten som hydrolyserades med PLE med hög enantioselektivitet. Även om utbytena är måttliga, är enantioselektiviteten extremt hög.
(3)
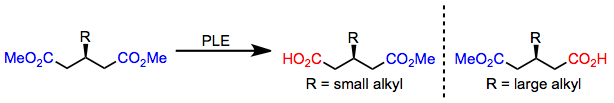
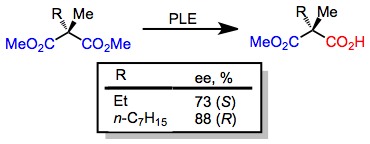
3-alkylglutarater med små alkylsubstituenter hydrolyseras till ( R )-monoestern; emellertid, när en stor alkylsubstituent är närvarande, bildas ( S )-monoestern. Denna omställning i enantioselektivitet förutsägs exakt av den aktiva platsmodellen som ges ovan.
(4)
En motsatt trend observeras i desymmetriserande hydrolyser av 2-metylmalonater , som ger ( S )-enantiomeren när den andra substituenten på C-2 är liten, och ( R )-enantiomeren när den andra C-2-substituenten är stor.
(5)
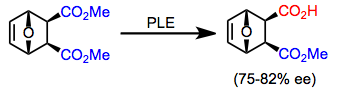
Ett antal mesodiestrar andra än de ovan beskrivna substraten kan hydrolyseras med PLE med hög enantioselektivitet. Cykliska mesodiestrar tenderar att hydrolyseras mer selektivt än acykliska diestrar. Den dominerande enantiomeren av produkten beror på ringstorleken.
(6)
7-Oxabicyklo[2.2.1]heptan-2,3-dikarboxylater är en intressant klass av diestrar som hydrolyseras av PLE med hög enantioselektivitet. Dessa substrat har använts för den enantioselektiva konstruktionen av biologiskt relevanta sockerarter (se Syntetiska tillämpningar nedan).
(7)
Racemiska blandningar av alla de ovan beskrivna substraten, såväl som ytterligare kirala diestrar (såsom epoxiestern i ekvation (8)), kan lösas med PLE för kinetisk upplösning. En betydande nackdel med kinetisk upplösning är ett maximalt utbyte av hydrolyserad produkt på 50 %. Men om snabb racemisering sker vid sidan av hydrolys (ett exempel på dynamisk kinetisk upplösning ), är ett maximalt utbyte på 100 % möjligt.
(8)
Esterasenzymer kan också användas för hydrolys av baskänsliga monoestrar. PLE har applicerats på syntesen av prostaglandiner för selektiv hydrolys av estern utan att förstöra β-hydroxiketondelen.
(9)
Syntetiska applikationer
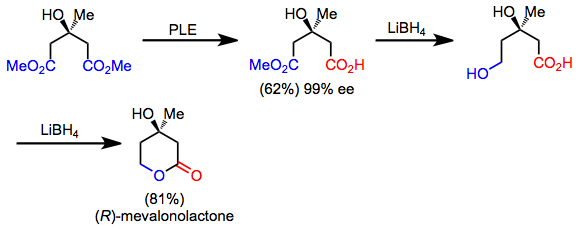
Ett antal syntetiska mål har dold symmetri som kan upptäckas genom att applicera en retrosyntetisk "symmetriserande" transform. I framåtriktningen motsvarar denna operation en desymmetriseringsreaktion. Till exempel kan mevalonolakton syntetiseras snabbt från en symmetrisk diester via desymmetriserande hydrolys, kemoselektiv reduktion och laktonisering. Även om själva produkten är asymmetrisk, tillåter desymmetriisering och funktionella gruppmanipulationer dess syntes från ett akiralt utgångsmaterial.
(10)
Enantioselektiv hydrolys av en konjugerad diester följt av ozonolys ger skelettet av ribos. Det resulterande sockret förs sedan vidare för syntes av nukleosider.
(11)
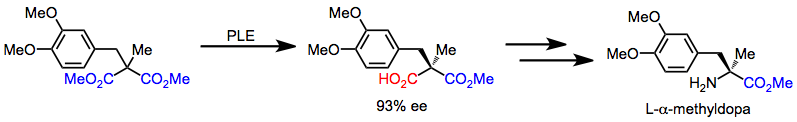
L-a-metyldopa kan snabbt syntetiseras från ett akiralt malonat genom en sekvens som börjar med desymmetrisering. Efterföljande kemoselektiva transformationer omvandlar karboxylsyran till en amin.
(12)
Jämförelse med andra metoder
Andra enzymer som kan användas för asymmetrisk esterhydrolys inkluderar elektrisk ålacetylkolinesteras, chymotrypsin och bakerjäst . Substratomfånget för dessa enzymer skiljer sig från PLE, och i vissa fall kan de ge hydrolyserade produkter med högre utbyte eller enantioselektivitet än PLE. Mikroorganismer kan också användas för enantioselektiv hydrolys; emellertid har svårigheter förknippade med hanteringen av mikroorganismer gjort dessa metoder impopulära för organisk syntes.
Icke-enzymatiska metoder för differentiering av enantiotopiska grupper använder kirala katalysatorer eller hjälpmedel. Till exempel leder införandet av en kiral lämnande grupp på båda karboxylsyragrupperna i en mesodisyra till selektiv attack av en akiral nukleofil vid en av de (nu) diastereotopiska karbonylgrupperna.
(13)
Experimentella villkor och tillvägagångssätt
Typiska förhållanden
Enzymatiska reaktioner begränsas av behovet av vattenhaltigt lösningsmedel och nästan neutrala reaktionsbetingelser. PLE-hydrolyser utförs vanligtvis med en fosfatbuffert för att bibehålla pH-värdet mellan 7 och 8. Eftersom lösligheten av substratet i det vattenhaltiga mediet är kritisk, tillsätts ibland en liten mängd av ett polärt organiskt hjälplösningsmedel till vattenlösningen av enzym. Kommersiellt tillgänglig PLE är av tillräcklig renhet för de flesta applikationer.