Aldehyd ferredoxinoxidoreduktas
| Identifierare för | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| aldehydferredoxinoxidoreduktas | |||||||||
| EG nr. | 1.2.7.5 | ||||||||
| CAS-nr. | 138066-90-7 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
| AFOR_N | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 struktur av ett hypertermofilt tungstopterin enzym, aldehyd ferredoxin oxidoreduktas
| |||||||||
| Identifiers | |||||||||
| Symbol | AFOR_N | ||||||||
| Pfam | PF02730 | ||||||||
| InterPro | IPR013983 | ||||||||
| SCOP2 | 1aor / SCOPe / SUPFAM | ||||||||
| |||||||||
| AFOR_C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifierare | |||||||||
| Symbol | AFOR_C | ||||||||
| Pfam | PF01314 | ||||||||
| InterPro | IPR001203 | ||||||||
| SCOP2 | 1aor / SCOPe / SUPFAM | ||||||||
| |||||||||
Inom enzymologi är ett aldehydferredoxinoxidoreduktas ( EC 1.2.7.5 ) ett enzym som katalyserar den kemiska reaktionen
- en aldehyd + H 2 O + 2 oxiderat ferredoxin ⇌ en syra + 2 H + + 2 reducerat ferredoxin
Detta enzym tillhör familjen oxidoreduktaser , speciellt de som verkar på donatorns aldehyd- eller oxogrupp med ett järn-svavelprotein som acceptor. Det systematiska namnet på denna enzymklass är aldehyd:ferredoxinoxidoreduktas . Detta enzym kallas även AOR . Det är ett relativt sällsynt exempel på ett volframinnehållande protein.
Förekomst
Den aktiva platsen i AOR-familjen har ett oxo-volframcentrum bundet till ett par molybdopterin- kofaktorer (som inte innehåller molybden) och ett 4Fe-4S- kluster. Denna familj inkluderar AOR, formaldehydferredoxinoxidoreduktas (FOR), glyceraldehyd-3-fosfatferredoxinoxidoreduktas (GAPOR), alla isolerade från hypertermofil arkea ; karboxylsyrareduktas som finns i klostridier; och hydroxikarboxylatviologenoxidoreduktas från Proteus vulgaris , den enda medlemmen av AOR-familjen som innehåller molybden. GAPOR kan vara involverad i glykolys , men funktionerna för de andra proteinerna är ännu inte klarlagda. AOR har föreslagits vara det primära enzymet som ansvarar för att oxidera de aldehyder som produceras av 2- ketosyraoxidoreduktaserna .
AOR finns i hypertermofil archaea, Pyrococcus furiosus . Arkeonerna Pyrococcus ES-4-stammen och Thermococcus ES-1-stammen skiljer sig åt genom deras substratspecificitet: AFOs visar ett bredare storleksintervall av dess aldehydsubstrat . Dess primära roll är att oxidera aldehyd som kommer från metabolismen av aminosyror och glukos. Aldehyd Ferredoxin Oxidoreductase är en medlem av en AOR-familj, som inkluderar glyceraldehyd-3-fosfatferredoxinoxidoreduktas (GAPOR) och formaldehydferredoxinoxidoreduktas.
Fungera
AOR fungerar vid höga temperaturer (~80 grader Celsius) vid ett optimalt pH på 8-9. Det är syrekänsligt eftersom det förlorar huvuddelen av sin aktivitet från syreexponering och arbetar i cytoplasman där det är en reducerande miljö. Sålunda orsakar antingen exponering för syre eller sänkning av temperaturen en irreversibel förlust av dess katalytiska egenskaper. Också, som ett resultat av syrekänslighet hos AOR, görs rening av enzymet under anoxiska miljöer.
Det föreslås att AOR har en roll i Entner-Doudoroff-vägen (glukosnedbrytning) på grund av dess ökade aktivitet med maltosinkorporering . Andra förslag inkluderar emellertid dess roll i oxidation av aminosyrametabolism, aldehydbiprodukter som kommer från deaminerade 2-ketosyror. Huvudsubstraten för aldehydferredoxinoxidoreduktas är acetaldehyd , fenylacetaldehyd och isovalerdehyd, som är en metabolisk produkt från vanliga aminosyror och glukos. Till exempel når acetaldehyd sitt kcat/KM-värde upp till 22,0 μM-1s-1. Faktum är att vissa mikroorganismer bara använder aminosyror som en kolkälla, såsom Thermococcus stam ES1; sålunda använder de aldehydferredoxinoxidoreduktas för att metabolisera aminosyrakolkällan.
Strukturera
AOR är homodimer. Varje 67 kDa subenhet innehåller 1 volfram och 4-5 järnatomer . De två underenheterna överbryggas av ett järncentrum med låg spinn. Man tror att de två subenheterna fungerar oberoende av varandra.
- Volfram-pterin
Volfram i det aktiva stället för AOR antar en förvrängd kvadratisk pyramidal geometri bunden till en oxo/hydroxo-ligand och ditiolensubstituenterna av två molybdopterin - kofaktorer.

Två molybdopterin -kofaktorer binder volfram, vilket observeras i många relaterade enzymer. Volfram binds inte direkt till proteinet. Fosfatcentra som hänger på kofaktorn är bundna till en Mg 2+ , som också är bunden av Asn93 och Ala183 för att fullborda sin oktaedriska koordinationssfär. Således är pterin- och volframatomer kopplade till AOR-enzymet främst genom pterins vätebindningsnätverk med aminosyraresterna. Dessutom deltar två vattenligander som upptar den oktaedriska geometrin i vätebindningsnätverk med pterin, fosfat och Mg 2+ . Medan [Fe4S4]-kluster är bundet av fyra Cys-ligander, interagerar Pterin - rikt på amino- och eterkopplingar - med Asp-XX-Gly-Leu-(Cys/Asp)-sekvenserna i AOR-enzymet. I en sådan sekvens är Cys494-resten också vätebunden till [Fe4S4]-klustret. Detta indikerar att Cys494-resten förbinder Tungsten-stället och [Fe4S4]-klusterstället i enzymet. Järnatomen i klustret är dessutom bunden av tre andra Cysteinligander: . En annan länkaminosyrarest mellan ferredoxinkluster och pterin är också Arg76, som vätebinder till både pterin och ferredoxin. Det föreslås att sådana vätebindningsinteraktioner innebär pterincykliska ringsystem som en elektronbärare. binder pterinets C= O -centrum Na + . W=O-centret föreslås, inte verifierat kristallografiskt.
AOR består av tre domäner, domän 1, 2 och 3. Medan domän 1 innehåller pterin bundet till volfram, tillhandahåller de andra två domänerna en kanal från volfram till proteinets yta (15 Ångström i längd) för att tillåta specifika substrat att komma in i enzym genom sin kanal. I det aktiva stället är dessa pterinmolekyler i en sadelliknande konformation (500 till det normala planet) för att "sitta" på domän 1 som också antar en form med beta-ark för att rymma Tungsten-Pterin-platsen.
- Järn
Järncentret mellan de två underenheterna har en strukturell roll i AOR. Järnmetallatomer antar en tetraedrisk konformation medan ligandkoordinationen kommer från två histidiner och glutaminsyror. Detta är inte känt för att ha någon funktionell roll i proteinets redoxaktivitet.
- Fe4S4 centrum
[Fe4S4]-kluster i AOR skiljer sig i vissa aspekter från andra ferredoxinmolekyler. EPR-mätningar bekräftar att den fungerar som en en-elektron skyttel.
Aldehydferredoxinoxidoreduktasmekanism
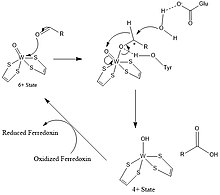
I den katalytiska cykeln omvandlas W(VI) (volfram "sex") till W(IV) samtidigt med oxidation av aldehyden till en karboxylsyra (motsvarande ett karboxylat). AW(V)-mellanprodukt kan detekteras med EPR-spektroskopi .
Allmän reaktionsmekanism för AOR:
- RCHO + H2O → RCO2H + 2H + + 2 e-
Redoxekvivalenterna tillhandahålls av 4Fe-4S-klustret.
En tyrosinrest föreslås för att aktivera det elektrofila centret av aldehyder genom H-bindning till karbonylsyreatomen, koordinerad till W-centrum. En glutaminsyrarest nära det aktiva stället aktiverar en vattenmolekyl för en nukleofil attack på aldehydkarbonylcentrum. Efter nukleofil attack av vatten överförs hydrid till oxo-volfram sie sålunda, . Därefter regenereras W(VI) genom elektronöverföring till 4Fe-4S-centret. Med formaldehydferredoxinoxidoreduktas skulle Glu308 och Tyr 416 vara involverade medan Glu313 och His448 visas vara närvarande i AOR-aktiva ställen.
Vidare läsning
- Mukund S, Adams MW (1991). "Det nya volfram-järn-svavelproteinet från den hypertermofila archaebacterium, Pyrococcus furiosus, är ett aldehydferredoxinoxidoreduktas. Bevis för dess deltagande i en unik glykolytisk väg" . J. Biol. Chem . 266 (22): 14208–16. doi : 10.1016/S0021-9258(18)98669-2 . PMID 1907273 .
- Johnson JL, Rajagopalan KV, Mukund S, Adams MW (1993). "Identifiering av molybdopterin som den organiska komponenten i volframkofaktorn i fyra enzymer från hypertermofil Archaea" . J. Biol. Chem . 268 (7): 4848–52. doi : 10.1016/S0021-9258(18)53474-8 . PMID 8444863 .
- Roy R, Menon AL, Adams MW (2001). "Aldehydoxidoreduktaser från Pyrococcus furiosus". Metoder Enzymol . 331 : 132–44. doi : 10.1016/S0076-6879(01)31052-2 . PMID 11265456 .