Tetrakloroluminat

|
|
| Namn | |
|---|---|
|
IUPAC-namn
Tetrakloroluminat(1–)
|
|
|
Systematiskt IUPAC-namn
Tetrakloroluminat(1-) |
|
Andra namn
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| 2297 | |
|
PubChem CID
|
|
|
|
|
|
| Egenskaper | |
| AICI4- _ _ | |
| Molar massa | 168,78 g-mol -1 |
| Strukturera | |
| T d | |
| Tetraedrisk | |
| Hybridisering | sp 3 |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Tetrakloroluminat [AlCl 4 ] - är en anjon som bildas av aluminium och klor . Anjonen har en tetraedrisk form, liknande koltetraklorid där kol ersätts med aluminium. Vissa tetrakloroluminater är lösliga i organiska lösningsmedel, vilket skapar en jonisk icke-vattenhaltig lösning, vilket gör dem lämpliga som komponent i elektrolyter för batterier. Till exempel används litiumtetrakloroluminat i vissa litiumbatterier .
Bildning
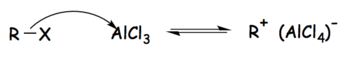
Tetrakloroluminatjoner bildas som mellanprodukter i Friedel-Crafts-reaktionerna när aluminiumklorid används som katalysator. I fallet med Friedel – Crafts-alkyleringen kan reaktionen delas upp i tre steg enligt följande:
Steg 1: Alkylhalogeniden reagerar med den starka Lewis-syran för att bilda en aktiverad elektrofil bestående av tetrakloroluminatjonen och alkylgruppen.
Steg 2: Den aromatiska ringen ( bensen i detta fall) reagerar med den aktiverade elektrofilen och bildar en alkylbenseniumkarbokatjon.
Steg 3: Alkylbensenkarbokatjonen reagerar med en tetrakloroluminatanjon, regenererar den aromatiska ringen och Lewissyran och bildar saltsyra (HCl).
En liknande mekanism förekommer i Friedel – Crafts acylering.