Syrat salt
Sura salter är en klass av salter som producerar en sur lösning efter att ha lösts upp i ett lösningsmedel . Dess bildning som ett ämne har en högre elektrisk ledningsförmåga än det rena lösningsmedlet. En sur lösning som bildas av surt salt görs under partiell neutralisering av diprotiska eller polyprotiska syror . En halvneutralisering uppstår på grund av återstående utbytbara väteatomer OH från den partiella dissociationen av svaga syror som inte har reagerat med hydroxidjoner ( − ) för att skapa vattenmolekyler.
Sur lösning och exempel på sura salter
Syra-bas- egenskapen hos den resulterande lösningen från en neutralisationsreaktion beror på de återstående saltprodukterna. Ett salt innehållande reaktiva katjoner genomgår hydrolys genom vilken de reagerar med vattenmolekyler, vilket orsakar deprotonering av konjugatsyrorna. Till exempel är syrasaltet ammoniumklorid den huvudsakliga arten som bildas vid halvneutralisering av ammoniak i saltsyralösning:
| Identitet: | Natriumbisulfat | Mononatriumfosfat | Dinatriumfosfat |
|---|---|---|---|
| Strukturformel | |||
| Kemisk formel |
NaHSO 4 |
NaH2PO4 _ _ _ |
Na 2 HPO 4 |
| IUPAC namn | Natriumvätesulfat | Natriumdivätefosfat | Dinatriumvätefosfat |
| Annat namn |
|
|
|
| Molekylvikt | 120,054 g/mol | 119,976 g/mol | 141,957 g/mol |
| Formell avgift | noll | noll | noll |
| Odör | Luktfri | Luktfri | Luktfri |
| Utseende | Vita kristaller eller granulat | Vitt kristallint pulver | Vitt, hygroskopiskt pulver |
| Strukturera |
|
Monoklina kristaller | Monoklina kristaller (vattenfria) |
| Löslighet |
|
|
|
|
Densitet |
|
0,5–1,2 g/cm 3 | 1,7 g/cm 3 |
|
Sönderfall (genom uppvärmning) |
Bildar natriumkarbonat, vatten och koldioxid | Avger giftiga ångor av fosfoxider och natriumoxid | Avger giftiga ångor av fosfor- och natriumoxider |
| Används |
|
|
|
Använd i mat
Sura salter används ofta i livsmedel som en del av jäsmedel. I detta sammanhang hänvisas till syrasalterna som "jäsande syror". Vanliga jässyror inkluderar grädde av tandsten och monokalciumfosfat .
Ett surt salt kan blandas med ett alkalisalt (som natriumbikarbonat eller bakpulver) för att skapa bakpulver som frigör koldioxid . Jäsningsmedel kan vara långsamverkande (t.ex. natriumaluminiumfosfat ) som reagerar vid upphettning, eller snabbverkande (t.ex. tandsten) som reagerar omedelbart vid låga temperaturer. Dubbelverkande bakpulver innehåller både långsam- och snabbverkande jäsmedel och reagerar vid låga och höga temperaturer för att ge jäsning under hela bakningsprocessen.
Dinatriumfosfat , Na 2 HPO 4 , används i livsmedel och mononatriumfosfat, NaH 2 PO 4 , används i djurfoder, tandkräm och evaporerad mjölk.
Syrans intensitet
En syra med högre K a- värde dominerar den kemiska reaktionen. Det fungerar som en bättre bidragsgivare av protoner ( H + ). En jämförelse mellan Ka vilken och Kb : indikerar syra-basegenskapen för den resulterande lösningen genom
- Lösningen är sur om K a > K b . Den innehåller en högre koncentration av H + -joner än koncentrationen av OH - joner på grund av mer omfattande katjonhydrolys jämfört med anjonhydrolys.
- Lösningen är alkali om K a < K b . Anjoner hydrolyserar mer än katjoner, vilket orsakar en överskridande koncentration av OH − joner.
- Lösningen förväntas vara neutral endast när Ka = K b .
Andra möjliga faktorer som kan variera pH-nivån i en lösning är de relevanta jämviktskonstanterna och de ytterligare mängderna av valfri bas eller syra.
Till exempel, i ammoniumkloridlösning är NH + 4 den huvudsakliga inverkan för sur lösning. Det har högre K- värde jämfört med vattenmolekyler; Ka för NH + 4 är 5,6 × 10 -10 och Kw för H2O är _ 1,0 _ × 10 -14 . _ _ Detta säkerställer dess deprotonering när den reagerar med vatten, och är ansvarig för pH under 7 vid rumstemperatur. Cl − kommer inte att ha någon affinitet för H + och inte heller någon tendens att hydrolysera Kb , eftersom dess Kb - värde är mycket lågt ( av Cl − är 7,7 × 10 −21 ).
Hydrolys av ammonium vid rumstemperatur ger:
Se även



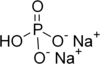

![{\displaystyle K_{\mathrm {a} }={\frac {\mathrm {[NH_{3}][H_{3}O^{+}]} }{\mathrm {[NH_{4}^{+}]} }}={\frac {K_{\mathrm {w} }}{K_{\mathrm {b} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eac34ff25fa376268b6f116d33bf3d00ca7dfab)
![{\displaystyle K_{\mathrm {a} }={\frac {[1.0\times 10^{-14}]}{[1.8\times 10^{-5}]}}={5.6}\times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43f0025153c13e4b649bc0ef2c4ea94caefc4c28)