Proinsulin
| insulin | |||||||
|---|---|---|---|---|---|---|---|
 Insulin genomgår omfattande posttranslationell modifiering längs produktionsvägen. Produktion och utsöndring är i stort sett oberoende; berett insulin lagras i väntan på utsöndring. Både C-peptid och moget insulin är biologiskt aktiva. Cellkomponenter och proteiner i denna bild är inte skalenliga.
| |||||||
| Identifierare | |||||||
| Symbol | INS | ||||||
| NCBI-genen | 3630 | ||||||
| HGNC | 6081 | ||||||
| OMIM | 176730 | ||||||
| RefSeq | NM_000207 | ||||||
| UniProt | P01308 | ||||||
| Övriga uppgifter | |||||||
| Ställe | Chr. 11 s15.5 | ||||||
| |||||||
Proinsulin är prohormonprekursorn till insulin som görs i betacellerna på de Langerhanska öarna, specialiserade regioner i bukspottkörteln . Hos människor kodas proinsulin av INS -genen . De Langerhanska öarna utsöndrar endast mellan 1 % och 3 % av proinsulin intakt. Men eftersom proinsulin har en längre halveringstid än insulin kan det stå för allt från 5–30 % av de insulinliknande strukturerna som cirkulerar i blodet. Det finns högre koncentrationer av proinsulin efter måltider och lägre nivåer när en person fastar. Dessutom, medan proinsulin och insulin har strukturella skillnader, visar proinsulin viss affinitet för insulinreceptorn . På grund av de relativa likheterna i struktur kan proinsulin producera mellan 5 % och 10 % av den metaboliska aktivitet som på liknande sätt induceras av insulin.
Proinsulin är den slutliga enkelkedjiga proteinstrukturen som utsöndras av celler före klyvning till moget insulin. Proinsulin upptäcktes av professor Donald F. Steiner vid University of Chicago 1967.
Strukturera
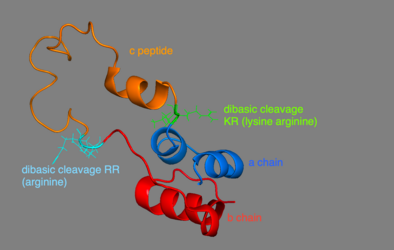
Proinsulin består av 86 rester hos människor (81 hos kor), och bildas av tre distinkta kedjor. A-kedjan, B-kedjan och området som förbinder de två kallas C-peptiden . Den korrekta strukturen av proinsulin är avgörande för korrekt veckning av moget insulin, eftersom placeringen av C-peptiden sätter upp molekylen för att skapa korrekt placerade disulfidbindningar i och mellan A- och B-kedjorna. Det finns tre disulfidbindningar som är nödvändiga för att moget insulin ska ha rätt struktur. Två av dessa disulfidbindningar är mellan A- och B-kedjorna, och en är en intra-A-kedjebindning. Disulfidbindningarna förekommer mellan den sjunde resten av A- och B-kedjan, den 20:e resten av A-kedjan och den 19:e resten av B-kedjan, och den 6:e och 11:e resten av A-kedjan.
C-peptiden är mellan A- och B-kedjorna av proinsulin. Kopplingen mellan A-kedjan och C-peptiden är mycket mer stabil än förbindelsen mellan C-peptiden och B-kedjan, med alfa-spiralformade egenskaper som uppvisas nära C-peptid-A-kedjekopplingen. C-peptid-A-kedjeövergången sker mellan resterna 64 och 65 av proinsulin. Dessa är lysin- respektive argininmolekyler . C-peptid-B-kedjekopplingen är mellan två argininrester vid positionerna 31 och 32 av proinsulin.
Det finns bevarande av mycket av strukturen hos proinsulin bland däggdjursarter, med mycket av restförändringarna från en art till en annan närvarande i C-peptiden. Som sagt, resterna av C-peptiden som är konserverade över arter interagerar med liknande konserverade rester på A- och B-kedjorna. Således antas det att dessa konserverade rester är viktiga för funktionaliteten hos moget insulin.
Syntes och posttranslationell modifiering
Proinsulin syntetiseras på membranassocierade ribosomer som finns på det grova endoplasmatiska retikulumet , där det viks och dess disulfidbindningar oxideras. Det transporteras sedan till Golgi-apparaten där det förpackas i sekretoriska vesiklar och där det bearbetas av en serie proteaser för att bilda moget insulin . Moget insulin har 35 färre aminosyror; 4 tas bort helt och hållet och de återstående 31 bildar C-peptiden . C-peptiden abstraheras från centrum av proinsulinsekvensen; de två andra ändarna (B-kedjan och A-kedjan) förblir förbundna med disulfidbindningar.
Den posttranslationella modifieringen av proinsulin till moget insulin sker endast i betacellerna på de Langerhanska öarna. När proinsulin transporteras genom Golgi-apparaten spjälkas C-peptiden. Denna klyvning sker med hjälp av två endoproteaser. Endoproteaser av typ I , PC1 och PC3, stör C-peptid-B-kedjekopplingen. PC2, ett endoproteas av typ II, klyver C-peptid-A-kedjebindningen. Den resulterande molekylen, nu moget insulin, lagras som en hexamer i sekretoriska vesiklar och stabiliseras med joner tills den utsöndras.
Immunogenicitet
När insulin ursprungligen renades från bukspottkörteln från nötkreatur eller svin , avlägsnades inte allt proinsulin helt. När vissa personer använde dessa insuliner kan proinsulinet ha fått kroppen att reagera med utslag, att motstå insulinet eller till och med göra bucklor eller klumpar i huden på den plats där insulinet injicerades. Detta kan beskrivas som en iatrogen skada på grund av små skillnader mellan olika arters proinsulin. Sedan slutet av 1970-talet, när högrenat svininsulin introducerades, och nivån av insulinrenhet nådde 99 %, har detta upphört att vara ett betydande kliniskt problem. Med avseende på deras inverkan på insulinfarmakokinetiken kan måttliga koncentrationer av vissa insulinantikroppar vara till positiva fördelar för alla diabetiker utan endogen insulinutsöndring (t.ex. personer med typ 1-diabetes) eftersom insulinbindande antikroppar effektivt ökar insulinets clearancehastighet och distributionsutrymme och hjälper till. för att förlänga dess farmakologiska och biologiska halveringstid. [ förtydligande behövs ]
Medicinsk relevans
Historiskt sett har fokus för många insulinrelaterade metabola sjukdomar fokuserats på moget insulin. Men på senare år har vikten av att studera strukturen och funktionen av proinsulin eller proinsulin:insulin-kvoten i förhållande till dessa sjukdomar blivit allt tydligare.
Diabetes mellitus
Ökade nivåer av proinsulin i cirkulationssystemet i förhållande till mogna insulinkoncentrationer kan indikera förestående insulinresistens och utveckling av typ 2-diabetes . Ytterligare problem med proinsulin som kan leda till diabetes inkluderar mutationer i antalet närvarande cysteiner, vilket kan påverka korrekt veckning. Om mutationen bara orsakar en mild förändring kan det helt enkelt betona det endoplasmatiska retikulumets förmåga att vika proteinet ordentligt. Denna stress skulle efter ett tag leda till en minskning av antalet β-celler som producerar moget insulin och skulle sedan leda till diabetes mellitus.
Neonatal diabetes mellitus
Postnatalt proinsulin är avgörande för metabolisk reglering. Proinsulin hos nyfödda är dock viktigt för normal utveckling av ögats nerver, utveckling av hjärtat och allmän överlevnad av embryonala celler. Reglering av koncentrationen av proinsulin under embryonal utveckling är avgörande, eftersom för mycket eller för lite av peptiden kan orsaka defekter och död hos fostret. Hittills i studien av neonatal diabetes mellitus har endast aminosyraförändringsmutationer som finns i B-domänen lett till sjukdomen.
Se även
- insulin
- preproinsulin
- signalpeptid
- signalpeptidpeptidas
- proprotein konvertas 1 (PC1)
- proprotein konvertas 2 (PC2)