ROSA1
| PINK1- | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , BRPK, PARK6, PTEN-inducerat förmodat kinas 1, PTEN-inducerat kinas 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
PTEN -inducerat kinas 1 ( PINK1 ) är ett mitokondriellt serin/treonin-proteinkinas som kodas av PINK1- genen .
Det tros skydda celler från stressinducerad mitokondriell dysfunktion. PINK1 - aktivitet gör att parkinproteinet binder till depolariserade mitokondrier för att inducera autofagi av dessa mitokondrier. PINK1 bearbetas av friska mitokondrier och frigörs för att utlösa neurondifferentiering. Mutationer i denna gen orsakar en form av autosomal recessiv tidig Parkinsons sjukdom .
Strukturera
PINK1 syntetiseras som ett 63000 Da -protein som ofta klyvs av PARL , mellan 103-alanin- och 104-fenylalaninresterna, till ett 53000 Da-fragment. PINK1 innehåller en N-terminal mitokondriell lokaliseringssekvens, en förmodad transmembransekvens, en Ser/Thr-kinasdomän och en C-terminal regulatorisk sekvens. Proteinet har visat sig lokaliseras till det yttre membranet av mitokondrier, men kan också hittas i hela cytosolen. Experiment tyder på att Ser/Thr-kinasdomänen är vänd utåt mot cytosolen, vilket indikerar en möjlig interaktionspunkt med parkin.
Strukturen för PINK1 har lösts och visar hur proteinet binder och fosforylerar sitt substrat ubiquitin.
Fungera
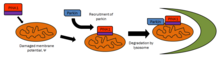
PINK1 är intimt involverad i mitokondriell kvalitetskontroll genom att identifiera skadade mitokondrier och rikta in sig på specifika mitokondrier för nedbrytning. Friska mitokondrier upprätthåller en membranpotential som kan användas för att importera PINK1 till det inre membranet där det klyvs av PARL och rensas från det yttre membranet. Svårt skadade mitokondrier saknar tillräcklig membranpotential för att importera PINK1, som sedan ackumuleras på det yttre membranet. PINK1 rekryterar sedan Parkin för att rikta in sig på de skadade mitokondrierna för nedbrytning genom autofagi . På grund av närvaron av PINK1 i hela cytoplasman har det föreslagits att PINK1 fungerar som en "scout" för att söka efter skadade mitokondrier.

PINK1 kan också kontrollera mitokondriernas kvalitet genom mitokondriell fission . Genom mitokondrisk fission skapas ett antal dottermitokondrier, ofta med en ojämn fördelning i membranpotential. Mitokondrier med en stark, frisk membranpotential var mer benägna att genomgå fusion än mitokondrier med låg membranpotential. Interferens med den mitokondriella fissionsvägen ledde till en ökning av oxiderade proteiner och en minskning av andningen. Utan PINK1 kan parkin inte effektivt lokaliseras till skadade mitokondrier, medan ett överuttryck av PINK1 gör att parkin lokaliseras till även friska mitokondrier. Dessutom var mutationer i både Drp1, en mitokondriell fissionsfaktor och PINK1 dödliga i Drosophila- modeller. Ett överuttryck av Drp1 kan dock rädda försökspersoner med brist på PINK1 eller parkin, vilket tyder på att mitokondriell fission initierad av Drp1 återskapar samma effekter av PINK1/parkin-vägen.
Förutom mitokondriell fission har PINK1 varit inblandad i mitokondriell motilitet. Ackumuleringen av PINK1 och rekryteringen av parkin riktar sig mot en mitokondrie för nedbrytning, och PINK1 kan tjäna till att öka nedbrytningshastigheten genom att stoppa mitokondriell motilitet. Överuttryck av PINK1 gav liknande effekter som att tysta Miro , ett protein som är nära förknippat med mitokondriell migration.
En annan mekanism för mitokondriell kvalitetskontroll kan uppstå genom mitokondrierhärledda vesiklar. Oxidativ stress i mitokondrier kan producera potentiellt skadliga föreningar inklusive felaktigt vikta proteiner eller reaktiva syrearter. PINK1 har visat sig underlätta skapandet av mitokondrierhärledda vesiklar som kan separera reaktiva syrearter och skjuta dem mot lysosomer för nedbrytning.
Sjukdomsrelevans
Parkinsons sjukdom kännetecknas ofta av degenerering av dopaminerga neuroner och förknippas med uppbyggnaden av felaktigt vikta proteiner och Lewy-kroppar . Mutationer i PINK1-proteinet har visat sig leda till en uppbyggnad av sådana felaktigt vikta proteiner i mitokondrierna hos både flug- och mänskliga celler. Specifikt har mutationer i serin/treoninkinasdomänen hittats hos ett antal Parkinsonspatienter där PINK1 misslyckas med att skydda mot stressinducerad mitokondriell dysfunktion och apoptos .
Farmakologisk manipulation
Hittills har det förekommit få rapporter om små molekyler som aktiverar PINK1 och deras löfte som potentiella behandlingar för Parkinsons sjukdom. Den första rapporten dök upp 2013 när Kevan Shokat och hans team från UCSF identifierade en nukleobas som kallas kinetin som en aktivator av PINK1. Därefter visades det av andra att nukleosidderivatet av kinetin, dvs kinetinribosid, uppvisade signifikant aktivering av PINK1 i celler. Dessutom visade monofosfatprodrugerna av kinetinribosid, ProTides, också aktivering av PINK1. I december 2017 identifierades niklosamid, ett anthelmintisk läkemedel, som en potent aktivator av PINK1 i celler och i neuroner.
Vidare läsning
- Heutink P (2006). "PINK-1 och DJ-1 - nya gener för autosomal recessiv Parkinsons sjukdom". PINK-1 och DJ-1 - nya gener för autosomal recessiv Parkinsons sjukdom . J. Neural Transm. Suppl . Journal of Neural Transmission. Supplementa. Vol. 70. s. 215–9. doi : 10.1007/978-3-211-45295-0_33 . ISBN 978-3-211-28927-3 . PMID 17017532 .
- Valente EM, Bentivoglio AR, Dixon PH, Ferraris A, Ialongo T, Frontali M, Albanese A, Wood NW (2001). "Lokalisering av ett nytt lokus för autosomal recessiv tidig Parkinsonism, PARK6, på mänsklig kromosom 1p35-p36" . Am. J. Hum. Genet . 68 (4): 895–900. doi : 10.1086/319522 . PMC 1275643 . PMID 11254447 .
- Khan NL, Valente EM, Bentivoglio AR, Wood NW, Albanese A, Brooks DJ, Piccini P (2002). "Klinisk och subklinisk dopaminerg dysfunktion i PARK6-kopplad parkinsonism: en 18F-dopa PET-studie". Ann. Neurol . 52 (6): 849–53. doi : 10.1002/ana.10417 . PMID 12447943 . S2CID 9275470 .
- Bonifati V, Dekker MC, Vanacore N, Fabbrini G, Squitieri F, Marconi R, Antonini A, Brustenghi P, Dalla Libera A, De Mari M, Stocchi F, Montagna P, Gallai V, Rizzu P, van Swieten JC, Oostra B , van Duijn CM, Meco G, Heutink P (2003). "Autosomal recessiv tidig parkinsonism är kopplad till tre loci: PARK2, PARK6 och PARK7" . Neurol. Sci . 23 Suppl 2: S59–60. doi : 10.1007/s100720200069 . PMID 12548343 . S2CID 13625056 .
- Valente EM, Brancati F, Caputo V, Graham EA, Davis MB, Ferraris A, Breteler MM, Gasser T, Bonifati V, Bentivoglio AR, De Michele G, Dürr A, Cortelli P, Filla A, Meco G, Oostra BA, Brice A, Albanese A, Dallapiccola B, Wood NW (2003). "PARK6 är en vanlig orsak till familjär parkinsonism" . Neurol. Sci . 23 Suppl 2: S117–8. doi : 10.1007/s100720200097 . PMID 12548371 . S2CID 21061495 .
- Nakajima A, Kataoka K, Hong M, Sakaguchi M, Huh NH (2004). "BRPK, ett nytt proteinkinas som visar ökat uttryck i muscancercellinjer med högre metastaserande potential". Cancer Lett . 201 (2): 195–201. doi : 10.1016/S0304-3835(03)00443-9 . PMID 14607334 .
- Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, González-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G, Wood NW (2004). "Äftlig tidig Parkinsons sjukdom orsakad av mutationer i PINK1". Vetenskap . 304 (5674): 1158–60. Bibcode : 2004Sci...304.1158V . doi : 10.1126/science.1096284 . PMID 15087508 . S2CID 33630092 .
- Healy DG, Abou-Sleiman PM, Ahmadi KR, Muqit MM, Bhatia KP, Quinn NP, Lees AJ, Latchmann DS, Goldstein DB, Wood NW (2004). "Genen ansvarig för PARK6 Parkinsons sjukdom, PINK1, påverkar inte vanliga former av parkinsonism". Ann. Neurol . 56 (3): 329–35. doi : 10.1002/ana.20206 . PMID 15349859 . S2CID 1235813 .
- Hatano Y, Li Y, Sato K, Asakawa S, Yamamura Y, Tomiyama H, Yoshino H, Asahina M, Kobayashi S, Hassin-Baer S, Lu CS, Ng AR, Rosales RL, Shimizu N, Toda T, Mizuno Y, Hattori N (2004). "Nya PINK1-mutationer i tidig parkinsonism". Ann. Neurol . 56 (3): 424–7. doi : 10.1002/ana.20251 . PMID 15349870 . S2CID 10853835 .
- Hatano Y, Sato K, Elibol B, Yoshino H, Yamamura Y, Bonifati V, Shinotoh H, Asahina M, Kobayashi S, Ng AR, Rosales RL, Hassin-Baer S, Shinar Y, Lu CS, Chang HC, Wu-Chou YH, Ataç FB, Kobayashi T, Toda T, Mizuno Y, Hattori N (2004). "PARK6-kopplad autosomal recessiv tidig parkinsonism i asiatiska befolkningar". Neurologi . 63 (8): 1482–5. doi : 10.1212/01.wnl.0000142258.29304.fe . PMID 15505170 . S2CID 13480500 .
- Healy DG, Abou-Sleiman PM, Gibson JM, Ross OA, Jain S, Gandhi S, Gosal D, Muqit MM, Wood NW, Lynch T (2006). "PINK1 (PARK6) associerad Parkinsons sjukdom i Irland". Neurologi . 63 (8): 1486–8. doi : 10.1212/01.wnl.0000142089.38301.8e . PMID 15505171 . S2CID 24418905 .
- Rogaeva E, Johnson J, Lang AE, Gulick C, Gwinn-Hardy K, Kawarai T, Sato C, Morgan A, Werner J, Nussbaum R, Petit A, Okun MS, McInerney A, Mandel R, Groen JL, Fernandez HH, Postuma R, Foote KD, Salehi-Rad S, Liang Y, Reimsnider S, Tandon A, Hardy J, St George-Hyslop P, Singleton AB (2005). "Analys av PINK1-genen i en stor kohort av fall med Parkinsons sjukdom" . Arkiv för neurologi . 61 (12): 1898–904. doi : 10.1001/archneur.61.12.1898 . PMID 15596610 .
- Beilina A, Van Der Brug M, Ahmad R, Kesavapany S, Miller DW, Petsko GA, Cookson MR (2005). "Mutationer i PTEN-inducerat förmodat kinas 1 associerat med recessiv parkinsonism har olika effekter på proteinstabilitet" . Proc. Natl. Acad. Sci. USA . 102 (16): 5703–8. Bibcode : 2005PNAS..102.5703B . doi : 10.1073/pnas.0500617102 . PMC 556294 . PMID 15824318 .
- Deng H, Le WD, Zhang X, Pan TH, Jankovic J (2005). "G309D och W437OPA PINK1 mutationer i kaukasiska Parkinsons sjukdom patienter" . Acta Neurol. Scand . 111 (6): 351–2. doi : 10.1111/j.1600-0404.2005.00383.x . PMID 15876334 . S2CID 10669009 .
- Li Y, Tomiyama H, Sato K, Hatano Y, Yoshino H, Atsumi M, Kitaguchi M, Sasaki S, Kawaguchi S, Miyajima H, Toda T, Mizuno Y, Hattori N (2005). "Klinikogenetisk studie av PINK1-mutationer i autosomal recessiv tidig parkinsonism". Neurologi . 64 (11): 1955–7. doi : 10.1212/01.WNL.0000164009.36740.4E . PMID 15955953 . S2CID 46024206 .